Brugia malayi
Brugia malayi Brug, 1927 è un nematode parassita dell'uomo, una delle tre specie appartenenti alla famiglia Onchocercidae che causa la filariasi linfatica, altrimenti detta "elefantiasi", malattia caratterizzata dal diffuso gonfiore degli arti inferiori. Gli altri due vermi filariali che causano identica malattia sono il Wuchereria bancrofti e il Brugia timori, che differiscono dal B. malayi morfologicamente, nei sintomi indotti all'ospite e nelle regioni in cui sono attive le infezioni.[1]
| Brugia malayi | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Eukaryota |
| Regno | Animalia |
| Sottoregno | Eumetazoa |
| Superphylum | Protostomia |
| Phylum | Nematoda |
| Classe | Secernentea |
| Ordine | Spirurida |
| Famiglia | Onchocercidae |
| Genere | Brugia |
| Specie | B. malayi |
| Nomenclatura binomiale | |
| Brugia malayi Brug, 1927 | |
I vettori di questo parassita sono alcuni tipi di zanzare distribuite in alcune zone del sud e del sudest asiatico. È una delle malattie tropicali che l'Organizzazione mondiale della sanità si prefigge di debellare entro il 2020, grazie allo sviluppo di un vaccino e farmaci specifici, oltre che nuovi metodi per contrastare i vettori del parassita.
Storia della scoperta modifica
Identificazione di un parassita distinto modifica
Lichentenstein e Brug identificarono per la prima volta il B. malayi come agente patogeno distinto nel 1927. Riportarono all'epoca di un nematode parassita dell'uomo nella zona nord di Sumatra che era fisiologicamente e morfologicamente differente dal W. bancrofiti comunemente presente a Giacarta, e chiamarono questa nuova specie Filaria malayi.[2] Malgrado gli studi epidemiologici che identificarono il nuovo nematode in India, Sri Lanka, Cina, Vietnam del Nord e Malaysia, la scoperta dei due biologi non fu accettata fino al 1940, con l'identificazione di due vermi adulti in India da parte dei biologi Rao e Mapelstone.[3]
Per la somiglianza con il W. bancrofiti Rao e Mapelstone proposero di chiamare la nuova specie Wuchereria malayi[2], ma nel 1960 fu proposto di dividere il vecchio genere Wuchereria creandone uno nuovo, il Brugia, rinominando così la nuova specie Brugia malayi. Mentre i parassiti del genere Wuchereria sono in grado di infettare unicamente gli esseri umani, i Brugia hanno invece la capacità di infettare diverse specie oltre l'uomo.[4]
Identificazione di due differenti ceppi di B. malayi modifica
Nel 1957 furono scoperte due sottospecie di B. malayi in Malesia, basandosi sull'osservazione di differenti modelli dello stadio larvale periodico del parassita (microfilaria).[5] La differenza di periodicità tra le due specie si riferisce al ciclo di 24 ore nelle quali le microfilarie sono rilevabili con diversa densità nel sangue,[4] e le cause di questo fenomeno rimangono tuttora sconosciute.[6]
- Periodicità notturna: le microfilarie non sono rilevabili nel sangue per quasi tutta la durata del giorno, ma hanno un picco improvviso tra mezzanotte e le 2.00 AM.
- Subperiodicità notturna: le microfilarie sono rilevabili nel sangue in tutte le 24 ore, ma hanno una densità superiore alla media tra mezzogiorno e le 8 di sera.[4]
Trasmissione: vettori e serbatoi modifica
I vettori di questo parassita sono alcune zanzare del genere Mansonia, Anopheles e Aedes.[6][7] La presenza delle infezioni causate dal B. malayi dipende quindi dalle condizioni favorevoli allo sviluppo di queste zanzare.
- La forma periodica notturna è trasmessa dal genere Mansonia e alcune zanzare del genere Anopheles nei pressi di paludi aperte e nelle aree in cui si coltiva il riso. Queste zanzare tendono a mordere durante la notte, e l'unico animale bersaglio sembra essere l'uomo.[4] Le infezioni naturali a carico di altri mammiferi sono rare, mentre ricreate in laboratorio su animali da sperimentazione non prolificano.[6]
- La forma notturna subperiodica è trasmessa da zanzare del genere Mansonia nelle foreste paludose, dove le zanzare tendono a mordere in qualunque ora del giorno. In questo caso l'infezione riguarda però anche altri mammiferi.[4] Gatti, cani, scimmie, nycticebus e criceti sono stati infettati con successo in laboratorio e costituiscono un importante campo di ricerca per debellare la malattia[4][6][7]
L'infezione si contrae nel tempo dopo centinaia o migliaia di morsicature da parte di zanzare infette, questo perché normalmente ad ogni morso vengono trasmesse un numero limitato di larve mature (stadio L3), e solo un 10% di queste riescono a evolversi in vermi adulti.[8] I soggetti che corrono il rischio di contrarre l'infezione sono dunque quelli che vivono abitualmente nelle zone endemiche, mentre il rischio per un turista di passaggio che dovesse trascorrere poco tempo in un'area a rischio avrebbe poche probabilità di essere infettato.[9]
Ciclo vitale modifica
Lo sviluppo e la riproduzione del parassita avviene in due fasi distinte: nella zanzara (il vettore) e nell'uomo (l'ospite). Entrambe le fasi sono imprescindibili per il ciclo vitale del nematode, che altrimenti non potrà svilupparsi in un verme adulto.
Fase di sviluppo nella zanzara:
La zanzare funge da vettore e ospite intermedio, è essenziale nel primo sviluppo larvale del parassita e nella sua trasmissione.
4. La zanzara si ciba del sangue umano da un soggetto infetto e preleva da questo i microfilaria (uova filiformi del nematode) che circolano nel flusso sanguigno.
5-7 Nella zanzara i microfilaria penetrano nell'intestino e successivamente migrano verso i muscoli del volo, dove iniziano a crescere per poi svilupparsi in larve, in un periodo che va dai 7 ai 21 giorni. All'interno della zanzara non avviene alcuna riproduzione sessuale dei parassiti.
8-1 Le larve dal potenziale infettante (stadio larvale L3 migrano verso la ghiandola salivare, dalla quale fuoriescono nel momento in cui la zanzara si ciba nuovamente di sangue umano infettando l'ospite.[10]
Fase di sviluppo nell'uomo: Il parassita si sviluppa completamente nel corpo umano, dove si riproduce sessualmente e depone le uova.
1-2 Le larve infettanti penetrano attivamente sotto la pelle attraverso il foro creato dal morso della zanzara e si sviluppano in vermi adulti nel sistema linfatico in un periodo di circa 6 mesi. Gli adulti possono vivere nel sistema linfatico dai 5 ai 15 anni[11]
3. I maschi e le femmine adulti si accoppiano, e la femmina produce giornalmente una media di 10.000 microfilarie al giorno.[11] Le microfilarie entrano dunque nel flusso sanguigno, mostrando alle analisi la classica periodicità a seconda del tipo di infezione contratta.
4. Un'altra zanzara si ciba del sangue dell'ospite infettato ingerendo nuovamente le microfilarie riprendendo il ciclo. Il prelievo delle uova dipende dal tipo di infezione, ovvero se nel momento in cui la zanzara morde l'ospite sono presenti o meno le microfilarie nel flusso sanguigno.[6][10]
Morfologia modifica
Adulti modifica
Gli esemplari adulti sono simili ai classici nematodi, lunghi e filiformi, come le altre specie possiedono unicamente muscoli longitudinali e si muovono attraverso un movimento a "S" del corpo.[12] Gli adulti sono generalmente più piccoli del W. bancrofti, anche se il dato non è completo poiché il numero di esemplari isolati finora è esiguo. Le femmine adulte sono larghe il doppio rispetto ai maschi, mentre le prime hanno in media una circonferenza di 50 mm, il dato nei maschi è di 25 mm.[13]
Microfilaria modifica
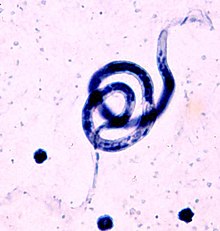
Le uova del B. malayi misurano tra i 200 e i 275 μm di lunghezza ed hanno l'estremità anteriore arrotondata e l'estremità anteriore appuntita. Il rivestimento di cui sono coperte viene rilevato tramite la colorazione di Giemsa, che ne indica quindi la presenza nel sangue. Questo rivestimento è in sostanza il guscio dell'uovo, che circonda la larva mentre questa circola nel sangue. Il rivestimento rimane integro finché i microfilaria non vengono ingeriti dalle zanzare nell'intestino.[6] I microfilaria di questo parassita sono molto simili a quelli del W. bancrofti e il Loa loa, ma le piccole differenze possono aiutare nell'identificazione dagli esami in laboratorio. Tra le differenze vi è una discontinuità del nucleo sulla punta della coda, laddove le uova del W. bancrofti non contiene affatto un nucleo e nel Loa loa il nucleo forma invece un filo continuo nella coda.[6][14]
Sintomi modifica
B. malayi è uno dei parassiti responsabili della filariasi linfatica, caratterizzata dall'infezione e gonfiore del sistema linfatico. La malattia è causata dalla presenza dei vermi nel sistema linfatico e la risposta dell'organismo ospite. I segni dell'infezione sono identici a quelli causati dal W. bancrofti, ovvero linfoadenopatia, linfedema e linfangite, oltre a infezioni batteriche collaterali, molto comuni.
Linfoadenopatia modifica
La linfoadenopatia, il gonfiore dei linfonodi, è un sintomo comune di molte malattie. Nelle prime manifestazioni della filariasi, la linfoadenopatia si manifesta spesso nella zona inguinale quando questa è causata dal B. malayi, e può insorgere prima della maturazione dei vermi.[6]
Linfangite modifica
La linfangite è l'infiammazione dell'apparato circolatorio linfatico in risposta all'infezione. Si manifesta inizialmente in risposta allo sviluppo dei vermi, alla muta, la morte o per infezioni batteriche e fungine. Il sistema colpito diventa teso e morbido, e la pelle sovrastante presenta eritemi e diventa calda. In alcuni casi l'infezione da B. malayi forma ascessi e ulcerazioni dei linfonodi colpiti, in percentuale maggiore rispetto alla filariasi causata dal W. bancrofti. Durante il drenaggio delle ulcere possono essere rinvenuti i resti di vermi adulti.[6]
Linfedema (elefantiasi) modifica
Il segno più evidente dell'infezione, l'elefantiasi, è l'ingrossamento a dismisura degli arti. Rappresenta un sintomo dell'infezione in stato avanzato, ed è un linfedema causato dalla continua infiammazione del sistema circolatorio linfatico. Ripetute infiammazioni causano l'allargamento e il restringimento del sistema affetto, compromettendone la funzionalità. Il sistema linfatico normalmente mantiene bilanciati i fluidi tra il sangue e i tessuti, ed è parte integrante del sistema immunitario. Il blocco della circolazione nei linfonodi causato dalla presenza di vermi morti e le fibrosi possono interferire con il normale bilanciamento dei fluidi, portando dunque al gonfiore delle estremità.[15] L'elefantiasi causata dal B. moryi affligge tipicamente la zona degli arti inferiori sotto il ginocchio. Diversamente dalle filariasi bancroftiane, il B. malayi colpisce raramente i genitali, e non causa orchiti e altri sintomi invalidanti spesso osservati con le infezioni causate dal W. bancrofti.[6]
Infezioni batteriche secondarie modifica
Le infezioni batteriche secondarie sono molto comuni nei pazienti affetti da filariasi. Il sistema immunitario compromesso a causa del danno linfatico, unito agli ascessi e le ulcerazioni dei linfonodi e la circolazione resa difficile dall'elefantiasi pongono condizioni favorevoli al proliferare di funghi e batteri. Una delle strategie per alleviare le sofferenze di chi è affetto da queste infezioni è di promuovere programmi di igiene per prevenire le infezioni batteriche e fungine.[6][16]
In ogni caso, le manifestazioni cliniche sono molto variabili e dipendono da diversi fattori, come lo stato del sistema immunitario dell'ospite prima dell'infezione, il livello di infestazione e il ceppo del parassita. Molte infezioni sono asintomatiche, ma variano spesso da individuo a individuo. Gli individui che vivono nelle zone endemiche del parassita possono anche non presentare sintomi, mentre in alcuni casi pochi vermi adulti nell'organismo possono dare luogo ad una seria risposta infiammatoria.[6] Lo sviluppo della malattia nell'uomo comunque non è ancora ben compreso. Gli adulti generalmente sviluppano i sintomi peggiori, a causa della lunga esposizione al parassita necessaria per lo sviluppo della malattia. L'infezione può colpire durante l'infanzia, ma per svilupparsi necessita di anni. Il periodo di incubazione varia da un mese a due anni, e normalmente le microfilarie vengono trovate nella circolazione sanguigna prima che possano presentarsi sintomi. Il linfedema può svilupparsi in sei mesi, mentre l'elefantiasi vera e propria può presentarsi anche dopo un solo anno dall'infezione in soggetti immunodepressi. Gli uomini sviluppano sintomi con maggiore gravità rispetto alle donne.[16]
Note modifica
- ^ Johhn, David T., and William A. Petri. Markell and Voge's Medical Parasitology. 9th ed. St. Louis: Saunders Elsevier, 2006.
- ^ a b Sasa, Manabu. 1979. A review on classification and geographic distribution on brugian filariasis. Joint WPRO/SEARO Working Group on Brugian Filariasis. World Health Organizatioin. Copia archiviata (PDF), su whqlibdoc.who.int. URL consultato il 5 marzo 2009 (archiviato dall'url originale il 4 giugno 2011).
- ^ Shiyung, Liu. 2006. Filaria and plasmodium: distribution of endemic diseases and western plain exploitation in Taiwan. XIV International Economic History Congress, Helsinki 2006, Session 46. http://www.helsinki.fi/iehc2006/papers2/Shiyung.pdf
- ^ a b c d e f J. F. B. Edeson e T. Wilson, The epidemiology of filariasis due to Wuchereria Bancrofti and Brugia Malayi, in Annual Review Entomology, vol. 9, 1964, pp. 245–268, DOI:10.1146/annurev.en.09.010164.001333..
- ^ Sasa, Manabu. 1979. A review on classification and geographic distribution on brugian filariasis. Joint WPRO/SEARO Working Group on Brugian Filariasis. World Health Organization. Copia archiviata (PDF), su whqlibdoc.who.int. URL consultato il 5 marzo 2009 (archiviato dall'url originale il 4 giugno 2011).
- ^ a b c d e f g h i j k l David T. John e William A. Petri, Markell and Voge's Medical Parasitology, 9th, St. Louis, Saunders Elsevier, 2006, ISBN 0-7216-4793-6..
- ^ a b Gideon Infectious Diseases Online. Brugia Malayi. http://web.gideononline.com/web/epidemiology/index.php?disease=10930&country=&view=General
- ^ P. Fischer, S. M. Erickson, K. Fischer, J. F. Fuchs, R. U. Rao, B. M. Christensen e G. J. Weil, Persistence of Brugia Malayi DNA in vector and non-vector mosquitoes: implication for xenomonitoring and transmission monitoring of lymphatic filariasis, in American Journal of Tropical Medicine Hygiene, vol. 76, n. 3, 2007, pp. 502–507..
- ^ Lymphatic Filariasis: Epidemiology and Risk Factors. The Centers for Disease Control and Prevention. http://www.cdc.gov/ncidod/dpd/parasites/lymphaticfilariasis/epidemiology_lymphatic_filar.htm
- ^ a b Life cycle of Brugia Malayi. The Centers for Disease Control. http://www.dpd.cdc.gov/dpdx/HTML/Frames/A-F/Filariasis/body_Filariasis_b_malayi.htm#Geographic%20Distribution Archiviato il 21 gennaio 2013 in Internet Archive.
- ^ a b Frederick S. Southwick, Infectious Disease: A Clinical Short Course, 2nd, New York, McGraw Hill Professional, 2007, ISBN 978-0-07-147722-2..
- ^ W. Decraemer, E. Karanastasi, D. Brown e T. Backeljau, Review of the ultrastructure of the nematode body cuticle and its phylogenetic interpretation, in Biological Reviews, vol. 78, n. 3, 2003, pp. 465–510, DOI:10.1017/S1464793102006115, PMID 14558593..
- ^ Brugia malayi. Web Atlas of Medical Parasitology, http://atlas.or.kr/atlas/alphabet_view.php?my_codeName=Brugia%20malayi
- ^ Bench aids for the diagnosis of filarial infections. Plate 2 – Brugia malayi, Brugia timori. World Health Organization 1997. http://www.dpd.cdc.gov/dpdx/hTML/Frames/DiagnosticProcedures/body_dp_bloodbenchaids.htm Archiviato il 15 febbraio 2013 in Internet Archive.
- ^ John H. Cross, Filarial Nematodes: Lymphatic Filariae Wuchereria Bancrofti and Brugia Malayi, in Medical Microbiology, 4th, The University of Texas Medical Branch at Galveston. The National Institutes of Health, 1996..
- ^ a b Lymphatic filariasis, The World Health Organization, World Health Organization..
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Brugia malayi
- Wikispecies contiene informazioni su Brugia malayi
Collegamenti esterni modifica
- Brugia_life_cycle_and_adults_in_lymphatics video by R. Rao. Ph.D [1]
- Brugia malayi at UMich, su animaldiversity.ummz.umich.edu.
- The Special Programme for Research and Training in Tropical Diseases (TDR). "Functional analysis of Brugia malayi genes". 2004. https://web.archive.org/web/20070218162622/http://www.who.int/tdr/research/progress/fil_str/function.htm
- University of Pittsburgh. "Researchers reveal genetic secrets of devastating human parasite". 20 September 2007. http://www.physorg.com/news109517312.html
- Hoerauf, Achim. "Targeting wolbachia, doxycycline reduces pathology of lymphatic filariasis". 18, September 2006. https://www.eurekalert.org/pub_releases/2006-09/plos-twd091806.php
- The World Health Organization's Global Program to Eliminate Lymphatic Filariasis: http://www.who.int/mediacentre/factsheets/fs102/en/
- The Global Alliance to Eliminate Lymphatic Filariasis: http://filariasis.org/ Archiviato il 31 marzo 2011 in Internet Archive.
- Gideon Infectious Diseases Online: http://web.gideononline.com/web/epidemiology/index.php?disease=10930&country=&view=General
- Parasite Image Library, Centers for Disease Control: https://web.archive.org/web/20130216142047/http://www.dpd.cdc.gov/dpdx/HTML/ImageLibrary/Filariasis_il.htm
