Idrazoni
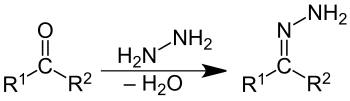
Gli idrazoni sono una classe di composti organici con struttura generale R1R2C=NNH2. Sono ottenuti per reazione di addizione nucleofila dell'idrazina con un chetone o una aldeide, con successiva eliminazione di acqua.

Gli idrazoni stabili derivano tipicamente da arilchetoni, mentre altri chetoni o aldeidi danno composti non isolabili che subiscono ulteriori reazioni.[1]
Usi modifica
La formazione di idrazoni aromatici è utilizzata per misurare la concentrazione di aldeidi e chetoni a basso peso molecolare, ad esempio in corrente di gas. Per esempio, la 2,4-dinitrofenilidrazina rivestita su un sorbente di silice è la base di una cartuccia di adsorbimento. Gli idrazoni sono quindi eluiti e analizzati tramite HPLC con rivelatore UV. In passato la formazione di un 2,4-dinitrofenilidrazone veniva sfruttata per identificare l'aldeide o il chetone, dopo avere cristallizzato il composto ottenuto e averne misurato il punto di fusione.
Il carbonil cianuro-p-trifluorometossifenil idrazone (FCCP) è utilizzato per disaccoppiare la sintesi dell'ATP e la riduzione dell'ossigeno nella fosforilazione ossidativa in biologia molecolare. La fenilidrazina reagisce col glucosio formando un osazone.
I metodi di accoppiamento basati sull'idrazone sono in biotecnologia medica per accoppiare i farmaci agli anticorpi target, per esempio gli anticorpi contro un certo tipo di cellule tumorali. Il legame basato sull'idrazone è stabile a pH neutro (nel sangue), ma è rapidamente distrutto nell'ambiente acido dei lisosomi della cellula. Il farmaco viene quindi rilasciato nella cellula, dove esercita la propria funzione.[2]
Reazioni modifica
Gli idrazoni reagiscono con I2 in ambiente basico producendo ioduri vinilici. Altre reazioni che producono composti vinilici sono la reazione di Shapiro e la reazione di Bamford-Stevens. Un idrazone viene formato come intermedio nella riduzione di Wolff–Kishner. Un altro metodo utilizzato per sintetizzare idrazoni è la reazione di Japp–Klingemann, che utilizza β-chetoacidi o β-chetoesteri e sali di arildiazonio.
N,N-dialchilidrazoni modifica
Negli N,N-dialchilidrazoni[3] il doppio legame C=N può essere idrolizzato, ossidato e ridotto, il legame N-N può essere ridotto formando l'ammina libera. L'atomo di carbonio del legame C=N può reagire con nucleofili organometallici. L'atomo di idrogeno in alfa è circa dieci volte più acido in confronto al chetone e quindi il carbonio corrispondente è più nucleofilo. Per esempio la deprotonazione con litio diisopropilammide produce un azaenolato che può essere alchilato da alogenuri alchilici, come descritto la prima volta da Elias James Corey e Dieter Enders nel 1978.[4][5] Nella sintesi asimmetrica SAMP e RAMP agiscono da ausiliario chirale con un idrazone chirale intermedio.[6][7][8]
Strutture enantiomere (R e S) di un'drazina chirale per la formazione di N,N-dialchilidrazoni per reazione con aldeidi e chetoni:
Note modifica
- ^ Michael B. Smith, Jerry March, March's Advanced Organic Chemistry, 6ª ed., John Wiley & Sons, Inc., 2007, p.1284, ISBN 0-471-72091-7.
- ^ Anna M. Wu e Peter D. Senter, Arming antibodies: prospects and challenges for immunoconjugates, in Nature Biotechnology, vol. 23, n. 9, Nature Publishing Group, 7 settembre 2005, pp. 1137-1146, DOI:10.1038/nbt1141.
- ^ R. Lazny e A. Nodzewska, N,N-dialkylhydrazones in organic synthesis. From simple N,N-dimethylhydrazones to supported chiral auxiliaries, in Chemical reviews, vol. 110, n. 3, 2010, pp. 1386–1434, DOI:10.1021/cr900067y.
- ^ E.J. Corey, Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds, in Tetrahedron Letters, vol. 17, n. 1, gennaio 1976, pp. 3-6, DOI:10.1016/S0040-4039(00)71307-4.
- ^ E.J. Corey e D. Enders, Herstellung und synthetische Verwendung von metallierten Dimethylhydrazonen Regio- und stereoselektive Alkylierung von Carbonylverbindungen, in Chemische Berichte, vol. 111, n. 4, aprile 1978, pp. 1337-1361, DOI:10.1002/cber.19781110413.
- ^ D. Enders, Enantioselective alkylation of aldehydes via metalated chiral hydrazones, in Tetrahedron Letters, vol. 18, n. 2, 1977, pp. 191-194, DOI:10.1016/S0040-4039(01)92585-7.
- ^ Dieter Enders, Peter Fey e Helmut Kipphardt, (S)-(−)-1-Amino-2-methoxymethylpyrrolidine (SAMP) and (R)-(+)-1-amino-2-methoxymethylpyrrolidine (RAMP), versatile chiral auxiliaries, in Org. Synth., vol. 65, 1987, p. 173.
- ^ Dieter Enders, Helmut Kipphardt e Peter Fey, Asymmetric syntheses using the SAMP-/RAMP-hydrazone method: (S)-(+)-4-methyl-3-heptanone, vol. 65, 1987, p. 183.
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Idrazone
Collegamenti esterni modifica
- (EN) IUPAC Gold Book, "hydrazones", su goldbook.iupac.org.
| Controllo di autorità | GND (DE) 4160881-1 · NDL (EN, JA) 00575230 |
|---|