Riarrangiamento di Meyer-Schuster
Il riarrangiamento di Meyer-Schuster è una reazione chimica descritta come un riarrangiamento acido-catalizzato di alcoli propargilici secondari e terziari in chetoni α, β-insaturi se il gruppo alchino è interno e in aldeidi α, β-insature se il gruppo alchino è terminale.[1] Alcune review sono state pubblicate da diversi autori, tra cui Swaminathan e Narayan,[2] Vartanyan e Banbanyan,[3] ed Engel e Dudley,[4] l'ultima delle quali descrive anche i modi per favorire il riarrangiamento di Meyer-Schuster su altre reazioni disponibili per gli alcoli propargilici.
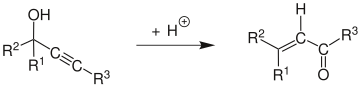
Meccanismo modifica
Il meccanismo di reazione[5] inizia con la protonazione dell'alcol, che dà luogo ad una reazione di eliminazione E1 per formare l'allene dall'alchino. L'attacco di una molecola d'acqua sul carbocatione formatosi e la deprotonazione sono seguiti dalla tautomerizzazione per dare il composto carbonilico α,β-insaturo.
Il meccanismo di reazione è stato studiato da Edens et al.[6] Hanno così scoperto che era caratterizzato da tre fasi principali: (1) la rapida protonazione dell'ossigeno, (2) il rate determining step comprendente lo spostamento 1,3 del gruppo idrossi- protonato e (3) la tautomeria cheto-enolica, seguita da rapida deprotonazione.
In uno studio sullo step cinetico limitante della reazione di Meyer-Schuster, Andres et al. hanno dimostrato che la driving force della reazione è la formazione irreversibile di composti carbonilici insaturi attraverso ioni al carbonio pentacoordinato.[7] È stato anche scoperto che la reazione dipende dal solvente e possa così essere favorita. Questo aspetto è stato ulteriormente studiato da Tapia et al. che ha mostrato che l'ingabbiamento del solvente stabilizza lo stato di transizione.[8]
Riarrangiamento di Rupe modifica
Se la reazione si svolge a partire da alcoli terziari contenenti un gruppo α-acetilenico, essa non produce le aldeidi attese, ma piuttosto metilchetoni α,β-insaturi tramite un intermedio eninico .[9][10] Questa reazione alternativa è chiamata reazione di Rupe e compete con il riarrangiamento di Meyer-Schuster nel caso degli alcoli terziari.
Uso di catalizzatori modifica
Il riarrangiamento di Meyer-Schuster nei primi utilizzi della reazione impiega condizioni pesanti come l'uso di un acido forte come catalizzatore e questo porta a competizione con la reazione di Rupe se l'alcol è terziario.[2] Condizioni più blande sono state utilizzate con successo, ad esempio, per mezzo di catalizzatori a base di metalli di transizione e acidi di Lewis (ad esempio, catalizzatori a base di Ru[11] e Ag[12]). Cadierno et al. hanno segnalato l'uso di radiazioni a microonde con InCl3 come catalizzatore per dare ottime rese con tempi di reazione brevi e notevole stereoselettività.[13] Di seguito è riportato un esempio tratto dal loro articolo:
Applicazioni modifica
Il riarrangiamento di Meyer-Schuster è stato utilizzato in una varietà di applicazioni, dalla conversione di ω-alchinil-ω-carbinololattami in enammidi usando PTSA catalitico[14], alla sintesi di tioesteri α,β-insaturi a partire da alcol propargilici γ-zolfo sostituiti[15], al riarrangiamento di 3-alchinil-3-idrossil-1H-isoindoli in condizioni leggermente acide per dare composti carbonilici α,β-insaturi.[16] Una delle applicazioni più interessanti è però la sintesi di una parte di paclitaxel in modo diastereomericamente selettivo che porta solo all'E-alchene.[17]
Il passaggio mostrato sopra ha avuto una resa del 70% (91% dopo il recupero del sottoprodotto, che può venire convertito nel prodotto della reazione di Meyer-Schuster in un altro step). Gli autori hanno utilizzato il riarrangiamento di Meyer-Schuster perché volevano convertire un chetone impedito stericamente in un alchene senza danneggiare il resto della molecola.
Note modifica
- ^ Meyer, K. H.; Schuster, K. Ber. 1922, 55, 819.(DOI: 10.1002/cber.19220550403)
- ^ a b Swaminathan, S.; Narayan, K. V. "The Rupe and Meyer-Schuster Rearrangements" Chem. Rev. 1971, 71, 429–438. (Review)
- ^ Vartanyan, S. A.; Banbanyan, S. O. Russ. Chem. Rev. 1967, 36, 670. (Review)
- ^ Engel, D.A.; Dudley, G.B. Organic and Biomolecular Chemistry 2009, 7, 4149–4158. (Review)
- ^ Li, J.J. In Meyer-Schuster rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 380–381.(DOI: 10.1007/978-3-642-01053-8_159)
- ^ Edens, M.; Boerner, D.; Chase, C. R.; Nass, D.; Schiavelli, M. D. J. Org. Chem. 1977, 42, 3403–3408. (DOI: 10.1021/jo00441a017)
- ^ Andres, J.; Cardenas, R.; Silla, E.; Tapia, O. J. Am. Chem. Soc. 1988, 110, 666–674. (DOI: 10.1021/ja00211a002)
- ^ Tapia, O.; Lluch, J.M.; Cardena, R.; Andres, J. J. Am. Chem. Soc. 1989, 111, 829–835. (DOI: 10.1021/ja00185a007)
- ^ Rupe, H.; Kambli, E. Helv. Chim. Acta 1926, 9, 672. (DOI: 10.1002/hlca.19260090185)
- ^ Li, J.J. In Rupe rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 513–514.(DOI: 10.1007/978-3-642-01053-8_224)
- ^ Cadierno, V.; Crochet, P.; Gimeno, J. Synlett 2008, 1105–1124. (DOI: 10.1055/s-2008-1072593)
- ^ Sugawara, Y.; Yamada, W.; Yoshida, S.; Ikeno, T.; Yamada, T. J. Am. Chem. Soc. 2007, 129, 12902-12903. (DOI: 10.1021/ja074350y)
- ^ Cadierno, V.; Francos, J.; Gimeno, J. Tetrahedron Lett. 2009, 50, 4773–4776.(DOI: 10.1016/j.tetlet.2009.06.040)
- ^ Chihab-Eddine, A.; Daich, A.; Jilale, A.; Decroix, B. J. Heterocycl. Chem. 2000, 37, 1543–1548.(DOI: 10.1002/jhet.5570370622)
- ^ Yoshimatsu, M.; Naito, M.; Kawahigashi, M.; Shimizu, H.; Kataoka, T. J. Org. Chem. 1995, 60, 4798–4802.(DOI: 10.1021/jo00120a024)
- ^ Omar, E.A.; Tu, C.; Wigal, C.T.; Braun, L.L. J. Heterocycl. Chem. 1992, 29, 947–951.(DOI: 10.1002/jhet.5570290445)
- ^ Crich, D.; Natarajan, S.; Crich, J.Z. Tetrahedron 1997, 53, 7139–7158.(DOI: 10.1016/S0040-4020(97)00411-0)
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Meyer-Schuster