Teofillina
La teofillina (nota anche con il nome di dimetilxantina) è un composto chimico, appartenente al gruppo degli alcaloidi. Più specificamente si tratta di una metilxantina e come farmaco viene utilizzata nella terapia di numerose malattie respiratorie, come la BPCO e l'asma bronchiale, con svariati nomi commerciali.
| Teofillina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
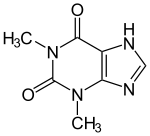
| 3,7-Diidro-1,3-dimetil-1H-purina-2,6-dione | |
| Nomi alternativi | |
| 1,3-dimetilxantina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H8N4O2 |
| Massa molecolare (u) | 180,2 |
| Aspetto | cristalli bianco-incolore |
| Numero CAS | |
| Numero EINECS | 200-385-7 |
| PubChem | 2153 |
| DrugBank | DB00277 |
| SMILES | CN1C2=C(C(=O)N(C1=O)C)NC=N2 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,5 |
| Solubilità in acqua | 5,5 - 8 g/L |
| Temperatura di fusione | 270-274 °C (543,15 - 547,15 K) |
| Dati farmacologici | |
| Categoria farmacoterapeutica | simpaticomimetico |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 301 |
| Consigli P | 270 - 264 - 310 - 301+330 - 405 [1] |
Fa parte dei composti azotati basici prodotti da alcune specie vegetali, è cioè un membro della famiglia delle xantine, e ha una grande somiglianza strutturale e farmacologica con la caffeina e la teobromina. È naturalmente contenuta soprattutto nelle foglie del tè, anche se in tracce (~ 1 mg/L)[2] significativamente inferiori rispetto alle dosi terapeutiche. La sostanza è contenuta in piccola quantità anche nel caffè e nelle fave di cacao. Dosaggi più elevati sono stati riscontrati nelle fave di cacao criollo,[3] un cacao di alta qualità, il più diffuso in America centrale e nel Nord del Sudamerica.
Storia modifica
La teofillina fu estratta dalle foglie di tè e chimicamente venne identificata intorno al 1888 dal biologo tedesco Albrecht Kossel.[4][5]
Appena sette anni dopo la sua scoperta, gli scienziati Emil Fischer e Lorenz Ach riuscirono a sintetizzarla chimicamente a partire dall'acido 1,3-dimetilurico.[6]
Un metodo alternativo per sintetizzare teofillina, il cosiddetto metodo Traube, fu introdotto nel 1900 da un altro scienziato tedesco, Wilhelm Traube.[7]
Il primo utilizzo clinico della teofillina avvenne nel 1902, come diuretico.[8] Furono necessari ulteriori venti anni di attesa prima di avere una prima descrizione dell'efficacia del farmaco nel trattamento dell'asma.[9]
Caratteristiche strutturali e chimiche modifica
Dal punto di vista chimico la teofillina è un derivato metilato della xantina: si tratta infatti della 1,3 - dimetilxantina.
Sintesi modifica
La teofillina può essere preparata per via sintetica a partire dalla dimetilurea e l'etil 2-cianoacetato.
Farmacodinamica modifica
La teofillina ha effetti stimolanti sul sistema nervoso centrale. Le principali azioni della teofillina sono:
- Rilassamento della muscolatura liscia bronchiale;
- Aumento della contrattilità del muscolo cardiaco (azione inotropa positiva);
- Aumento della frequenza cardiaca (azione cronotropa positiva);
- Aumento del flusso ematico renale;
- Azione di tipo anti-infiammatorio;
- Azione di stimolazione del sistema nervoso centrale, in particolare sul centro respiratorio midollare.
L'inibizione della fosfodiesterasi è il principale meccanismo d'azione della teofillina.[10] Tale azione determina l'aumento dell'AMPc (AMP ciclico) intracellulare, attiva la protein-chinasi AMPc dipendente determinando una inibizione del TNF-alpha[11][12] e dei leucotrieni.[13]
Sono stati proposti anche altri meccanismi d'azione alternativi e fra questi in particolare il possibile blocco dei recettori per l'adenosina e alcuni effetti sul trasporto intracellulare del calcio.
È stato dimostrato che la teofillina può risolvere il problema della scarsa sensibilità agli steroidi nei pazienti fumatori attivi con BPCO e/o asma bronchiale. In tali pazienti si verifica uno stress ossidativo. La teofillina in vitro ha dimostrato di poter ripristinare la ridotta attività della deacetilasi (HDAC) indotta dallo stress ossidativo stesso, ripristinando una normale sensibilità agli steroidi.[14]
Farmacocinetica modifica
Assorbimento modifica
Quando la teofillina viene somministrata per via endovenosa, la biodisponibilità è del 100%.[15][16] Se assunta per via orale, l'assunzione del farmaco in tarda serata potrebbe rallentarne il processo di assorbimento, senza comunque influenzare la biodisponibilità. L'assorbimento del farmaco è decisamente più veloce se la somministrazione avviene immediatamente dopo un pasto ad alto contenuto proteico, piuttosto che dopo un pasto ricco di grassi o di carboidrati,[17] ma la biodisponibilità non ne viene influenzata. Secondo un altro studio solamente un pasto ricco in carboidrati o un pasto completo, ma non il cibo ricco in grassi o proteine, sarebbe in grado di ritardare l'assorbimento della teofillina.[18]
Distribuzione modifica
La teofillina si distribuisce rapidamente nel fluido extracellulare, nella placenta, nel latte materno e nel sistema nervoso centrale.
Il volume di distribuzione è di 0,5 L/kg. Il legame con le proteine è del 40%.
Il volume di distribuzione può aumentare nei neonati[19][20][21] e nei soggetti affetti da cirrosi o malnutrizione, mentre diminuisce nei soggetti obesi.
Metabolismo modifica
La teofillina viene ampiamente metabolizzata nel fegato (fino al 70%). Subisce N-demetilazione attraverso il citocromo P4501A1 e P4501A2.[22][23][24] Un piccolo aumento del dosaggio può provocare un aumento sproporzionatamente grande delle concentrazioni sieriche. I fumatori e le persone con insufficienza epatica metabolizzano la teofillina in modo diverso. Gli idrocarburi policiclici aromatici presenti nel fumo di sigaretta infatti sono in grado di indurre i citocromi P4501A1 e P4501A2.[22] Il citocromo P4501A2 (CYP1A2) rappresenta circa il 10-15% del contenuto totale di citocromi del fegato umano ed è il principale enzima coinvolto nel metabolismo di numerosi farmaci e sostanze (imipramina, propranololo, clozapina, caffeina e altre ancora), la cui assunzione pertanto determina un'ampia variabilità del metabolismo della teofillina.[25][26]
Eliminazione modifica
La teofillina è escreta immodificata nelle urine (fino al 10%).
La clearance del farmaco è aumentata nei bambini di età compresa tra 1 e 12 anni,[27][28] negli adolescenti (da 12 a 16 anni),[20] nei fumatori adulti e anziani,[29][30] nella fibrosi cistica,[31][32] nell'ipertiroidismo. La clearance del farmaco si riduce invece negli anziani, nei soggetti con insufficienza cardiaca acuta congestizia,[33][34] nella cirrosi epatica, nell'ipotiroidismo e nelle malattie virali febbrili.
Anche l'emivita di eliminazione è estremamente variabile: 30 ore per i neonati prematuri,[35] 24 ore per i neonati, 3,5 ore per i bambini di età compresa tra 1 e 9 anni,[36] 8 ore per adulti non fumatori, 5 ore per i fumatori adulti,[30][37] circa 3,5 ore per i soggetti affetti da fibrosi cistica,[31] 24 ore per soggetti con insufficienza epatica,[38] 12 ore per soggetti con insufficienza cardiaca congestizia classe NYHA I-II,[39] 24 ore per soggetti con insufficienza cardiaca congestizia di classe NYHA III-IV,[40] 12 ore per gli anziani.
Usi clinici modifica
Il farmaco viene impiegato principalmente come broncodilatatore, assieme ad altri farmaci, nelle BPCO stabili (broncopneumopatie croniche ostruttive), nell'asma bronchiale e più in generale nelle affezioni polmonari con componente spastica bronchiolare. Viene anche utilizzato nell'apnea del bambino. Può essere inoltre utilizzato come bloccante dell'azione dell'adenosina. L'utilizzo della teofillina per via endovenosa nell'asma acuto dell'adulto è in diminuzione: sembra infatti che vi siano scarse evidenze di efficacia.[41]
Usi clinici in medicina veterinaria modifica
La teofillina in medicina veterinaria viene utilizzata come broncodilatatore per il trattamento dell'asma e del broncospasmo in generale. Questa molecola esercita anche effetti stimolanti sulla respirazione (attività analettica), sul sistema nervoso centrale (aumento dello stato di allerta e riduzione della sensazione di affaticamento) sul cuore (effetto inotropo e cronotropo positivi), sul sistema circolatorio (vasocostrizione/vasodilatazione distrettuale) e sul rene (debole azione diuretica). Fin dagli anni '80 sono stati effettuati diversi studi per valutare la biodisponibilità e la cinetica della teofillina nel cavallo. Dai lavori scientifici, presenti in bibliografia, emerge che per mantenere una concentrazione plasmatica di teofillina nei range terapeutici, è necessario somministrare 5 mg/kg di principio attivo, per via orale, ogni 12 ore. Gli stessi studi, effettuati più recentemente sul cane hanno dimostrato che servono dosaggi di 10 mg/kg, cioè doppi rispetto a quelli utilizzati nel cavallo per raggiungere un livello plasmatico di teofillina tale da considerarsi terapeutico[42][43]. Tali quantità non sono sufficienti nel gatto, dove sono necessari 15 mg/kg di teofillina[44]. La specie domestica in cui è largamente utilizzata la molecola in esame, è sicuramente quella equina. È indicata negli stati broncospastici reversibili associati a bronchite acuta, bronchite cronica, bronchite cronica ostruttiva (COPD), enfisema polmonare, enfisema polmonare cronico e sintomi a essi correlati: tosse, dispnea e facile affaticamento. Infine è indicata in corso di broncopolmoniti acute e croniche. In commercio esiste una formulazione di teofillina microincapsulata (Megabron), questa presentazione consente una cessione graduale di principio attivo. Una somministrazione ogni 12 ore consente di mantenere livelli plasmatici efficaci e privi di effetti indesiderabili. Dopo la prima somministrazione, il principio attivo raggiunge la massima concentrazione plasmatica alla quarta/quinta ora per poi decrescere e non essere più evidenziabile nel sangue dopo 72 ore[45][46]. Secondo uno studio condotto proprio per valutare la cinetica della teofillina microincapsulata nel cavallo è emerso che, rispetto a una formulazione granulare, è completamente assorbibile nel tratto gastroenterico. Inoltre, dopo ripetuti trattamenti la concentrazione sierica si mantiene a livelli terapeutici, senza effetti tossici per i cavalli trattati[47].
Tossicologia modifica
Controindicazioni modifica
La teofillina è controindicata, oltre che nei soggetti con ipersensibilità nota al principio attivo, anche nei soggetti con infarto del miocardio. Particolare prudenza è richiesta nella somministrazione a soggetti anziani, cardiopatici, ipertesi, con cuore polmonare cronico e insufficienza cardiaca congestizia.
Effetti collaterali e indesiderati modifica
La teofillina si caratterizza per avere un basso indice terapeutico, quindi, come nel caso di molti altri farmaci per l'asma, il suo uso deve essere attentamente monitorato per evitare la tossicità.
L'uso clinico del farmaco è ulteriormente complicato dalla sua interazione con varie sostanze, in particolare con la cimetidina[48][49][50] e la fenitoina[51][52] inoltre va sempre considerata una grande variabilità farmacocinetica tra i pazienti.
Il farmaco può causare nausea e talvolta diarrea, palpitazioni e tachicardia, tachiaritmie e fibrillazione atriale, sincope.[53][54] A carico del sistema nervoso può determinare cefalea, tremori, insonnia, irritabilità, capogiri e convulsioni. Ansia, agitazione, vertigini e sensazione di testa vuota e depressione sono altri effetti indesiderati segnalati in letteratura.[55][56]
In molti casi di tossicità si possono verificare convulsioni che vanno considerate come un'emergenza neurologica.[57] Oltre alle convulsioni in caso di tossicità è possibile il verificarsi di gravi aritmie.[58] Gli effetti tossici del farmaco sono aumentati dalla contemporanea somministrazione di eritromicina, cimetidina e i fluorochinoloni (ciprofloxacina, levofloxacina e altri). Il farmaco può raggiungere livelli tossici se assunto con pasti grassi. Questo effetto è stato definito "dose dumping".[59]
La tossicità da teofillina può essere trattata con i farmaci beta-bloccanti.[58]
Dosi terapeutiche modifica
Il trattamento per via endovenosa è riservato ai casi acuti e gravi di asma bronchiale.
Il farmaco (in genere 480 mg di aminofillina, pari a 2 fiale da 240 mg/10 mL) viene prima diluito in una soluzione per infusione compatibile (ad esempio 100 mL di soluzione fisiologica, soluzione glucosata, soluzione levulosica) e quindi viene infuso lentamente, avendo cura di non superare la velocità di infusione di 7,2 mL/minuto (pari a 25 mg di aminofillina/minuto).
Alla dose di carico si potrà far seguire un'infusione di mantenimento ottenuta diluendo 240 mg di aminofillina (pari a 1 fiala da 240 mg/10 mL) in 500 mL di soluzione per infusione. La velocità dell'infusione di mantenimento varierà da 1,9 mL/kg/ora (adulti sotto i 50 anni, fumatori) a 0,9 mL/kg/ora (adulti sotto i 50 anni, non fumatori).
Nei soggetti con scompenso cardiaco o compromissione epatica la dose dovrà essere ulteriormente ridotta: 0,5 mL/kg/ora.
Sovradosaggio modifica
Interazioni modifica
- Fenitoina: la terapia di associazione con teofillina comporta un aumento della clearance di quest'ultima e ne riduce l'emivita plasmatica.
- Allopurinolo: la co-somministrazione con la xantina può determinare un aumento della concentrazione plasmatica di quest'ultima.
Note modifica
- ^ scheda della teofillina su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Food Surveillance Information Sheet Number 103, su archive.food.gov.uk, MAFF Archive. URL consultato il 10 agosto 2012. (archiviato dall'url originale il 27 settembre 2006).
- ^ Joan L. Apgar e Stanly M. Tarka, Jr., Methylxanthine composition and consumption patterns of cocoa and chocolate products, in Gene A. Spiller (a cura di), Caffeine, CRC Press, 1998, p. 171, ISBN 0-8493-2647-8.
- ^ Kossel A, Über eine neue Base aus dem Pflanzenreich, in Ber. Dtsch. Chem. Ges., vol. 21, 1888, pp. 2164–2167, DOI:10.1002/cber.188802101422.
- ^ Kossel A, Über das Theophyllin, einen neuen Bestandtheil des Thees, in Hoppe Seylers Z. Physiol. Chem., vol. 13, 1889, pp. 298–308.
- ^ Fischer E, Ach L, Synthese des Caffeins, in Ber. Dtsch. Chem. Ges., vol. 28, 1895, p. 3139.
- ^ Traube W, Der synthetische Aufbau der Harnsäure, des Xanthins, Theobromins, Theophyllins und Caffeïns aus der Cyanessigsäure], in Chem. Ber., vol. 33, n. 3, 1900, pp. 3035–3056, DOI:10.1002/cber.19000330352.
- ^ Minkowski O, Über Theocin (Theophyllin) als Diureticum, in Ther. Gegenwart, vol. 43, 1902, pp. 490–493.
- ^ Schultze-Werninghaus G, Meier-Sydow J, The clinical and pharmacological history of theophylline: first report on the bronchospasmolytic action in man by S. R. Hirsch in Frankfurt (Main) 1922, in Clin. Allergy, vol. 12, n. 2, 1982, pp. 211–215, DOI:10.1111/j.1365-2222.1982.tb01641.x, PMID 7042115.
- ^ Essayan DM, Cyclic nucleotide phosphodiesterases, in J. Allergy Clin. Immunol., vol. 108, n. 5, novembre 2001, pp. 671–80, DOI:10.1067/mai.2001.119555, PMID 11692087.
- ^ Deree J, Martins JO, Melbostad H, Loomis WH, Coimbra R, Insights into the regulation of TNF-alpha production in human mononuclear cells: the effects of non-specific phosphodiesterase inhibition, in Clinics (Sao Paulo), vol. 63, n. 3, giugno 2008, pp. 321–8, PMC 2664230, PMID 18568240.
- ^ Marques LJ, Zheng L, Poulakis N, Guzman J, Costabel U, Pentoxifylline inhibits TNF-alpha production from human alveolar macrophages, in Am. J. Respir. Crit. Care Med., vol. 159, n. 2, febbraio 1999, pp. 508–11, PMID 9927365.
- ^ Peters-Golden M, Canetti C, Mancuso P, Coffey MJ, Leukotrienes: underappreciated mediators of innate immune responses, in J. Immunol., vol. 174, n. 2, gennaio 2005, pp. 589–94, PMID 15634873.
- ^ Ito K, Lim S, Caramori G, et al., A molecular mechanism of action of theophylline: Induction of histone deacetylase activity to decrease inflammatory gene expression, in Proc. Natl. Acad. Sci. U.S.A., vol. 99, n. 13, giugno 2002, pp. 8921–6, DOI:10.1073/pnas.132556899, PMC 124399, PMID 12070353.
- ^ Mitenko PA, Ogilvie RI, Pharmacokinetics of intravenous theophylline, in Clin. Pharmacol. Ther., vol. 14, n. 4, 1973, pp. 509–13, PMID 4723258.
- ^ Hughey MC, Yost RL, Robinson JD, Harman EM, Investigation of a dosage regimen for intravenous theophylline, in Drug Intell Clin Pharm, vol. 16, n. 4, aprile 1982, pp. 301–5, PMID 7067620.
- ^ Welling PG, Lyons LL, Craig WA, Trochta GA, Influence of diet and fluid on bioavailability of theophylline, in Clin. Pharmacol. Ther., vol. 17, n. 4, aprile 1975, pp. 475–80, PMID 1122688.
- ^ Johansson O, Lindberg T, Melander A, Wåhlin-Boll E, Different effects of different nutrients on theophylline absorption in man, in Drug Nutr Interact, vol. 3, n. 4, 1985, pp. 205–11, PMID 4064930.
- ^ Simons FE, Rigatto H, Simons KJ, Pharmacokinetics of theophylline in neonates, in Semin. Perinatol., vol. 5, n. 4, ottobre 1981, pp. 337–45, PMID 7302609.
- ^ a b Haley TJ, Metabolism and pharmacokinetics of theophylline in human neonates, children, and adults, in Drug Metab. Rev., vol. 14, n. 2, 1983, pp. 295–335, DOI:10.3109/03602538308991392, PMID 6341027.
- ^ Giacoia G, Jusko WJ, Menke J, Koup JR, Theophylline pharmacokinetics in premature infants with apnea, in J. Pediatr., vol. 89, n. 5, novembre 1976, pp. 829–32, PMID 789845.
- ^ a b Sarkar MA, Jackson BJ, Theophylline N-demethylations as probes for P4501A1 and P4501A2, in Drug Metab. Dispos., vol. 22, n. 6, 1994, pp. 827–34, PMID 7895598.
- ^ Sarkar MA, Hunt C, Guzelian PS, Karnes HT, Characterization of human liver cytochromes P-450 involved in theophylline metabolism, in Drug Metab. Dispos., vol. 20, n. 1, 1992, pp. 31–7, PMID 1346993.
- ^ Zhang ZY, Kaminsky LS, Characterization of human cytochromes P450 involved in theophylline 8-hydroxylation, in Biochem. Pharmacol., vol. 50, n. 2, luglio 1995, pp. 205–11, PMID 7632164.
- ^ Brøsen K, Drug interactions and the cytochrome P450 system. The role of cytochrome P450 1A2, in Clin Pharmacokinet, 29 Suppl 1, 1995, pp. 20–5, PMID 8846619.
- ^ Carrillo JA, Benitez J, Clinically significant pharmacokinetic interactions between dietary caffeine and medications, in Clin Pharmacokinet, vol. 39, n. 2, agosto 2000, pp. 127–53, PMID 10976659.
- ^ Rosen JP, Danish M, Ragni MC, Saccar CL, Yaffe SJ, Lecks HI, Theophylline pharmacokinetics in the young infant, in Pediatrics, vol. 64, n. 2, agosto 1979, pp. 248–51, PMID 471616.
- ^ Simons FE, Simons KJ, Pharmacokinetics of theophylline in infancy, in J Clin Pharmacol, vol. 18, n. 10, ottobre 1978, pp. 472–6, PMID 711929.
- ^ Powell JR, Thiercelin JF, Vozeh S, Sansom L, Riegelman S, The influence of cigarette smoking and sex on theophylline disposition, in Am. Rev. Respir. Dis., vol. 116, n. 1, luglio 1977, pp. 17–23, PMID 879596.
- ^ a b Hunt SN, Jusko WJ, Yurchak AM, Effect of smoking on theophylline disposition, in Clin. Pharmacol. Ther., vol. 19, 5 Pt 1, maggio 1976, pp. 546–51, PMID 1277710.
- ^ a b Georgitis JW, Eigen H, Warner R, Gonzales MA, Oral theophylline disposition in cystic fibrosis, in Ann Allergy, vol. 48, n. 3, marzo 1982, pp. 175–7, PMID 7065481.
- ^ Isles A, Spino M, Tabachnik E, Levison H, Thiessen J, MacLeod S, Theophylline disposition in cystic fibrosis, in Am. Rev. Respir. Dis., vol. 127, n. 4, aprile 1983, pp. 417–21, PMID 6838048.
- ^ Jenne JW, Chick TW, Miller BA, Strickland RD, Apparent theophylline half-life fluctuations during treatment of acute left ventricular failure, in Am J Hosp Pharm, vol. 34, n. 4, aprile 1977, pp. 408–9, PMID 860722.
- ^ Piafsky KM, Sitar DS, Rangno RE, Ogilvie RI, Theophylline kinetics in acute pulmonary edema, in Clin. Pharmacol. Ther., vol. 21, n. 3, marzo 1977, pp. 310–6, PMID 837650.
- ^ Aranda JV, Sitar DS, Parsons WD, Loughnan PM, Neims AH, Pharmacokinetic aspects of theophylline in premature newborns, in N. Engl. J. Med., vol. 295, n. 8, agosto 1976, pp. 413–6, DOI:10.1056/NEJM197608192950803, PMID 934239.
- ^ Kadlec GJ, Ha LT, Jarboe CH, Richards D, Karibo JM, Theophylline half-life in infants and young children, in Ann Allergy, vol. 40, n. 5, maggio 1978, pp. 303–10, PMID 646186.
- ^ Jenne H, Nagasawa H, McHugh R, MacDonald F, Wyse E, Decreased theophylline half-life in cigarette smokers, in Life Sci., vol. 17, n. 2, luglio 1975, pp. 195–8, PMID 1160495.
- ^ Baselt RC, Albertson TE, Markedly prolonged theophylline half-life in liver failure, in J Anal Toxicol, vol. 6, n. 2, 1982, pp. 62–3, PMID 7098449.
- ^ Kuntz HD, Straub H, May B, Theophylline elimination in congestive heart failure, in Klin. Wochenschr., vol. 61, n. 21, novembre 1983, pp. 1105–6, PMID 6645309.
- ^ Jeong CS, Hwang SC, Jones DW, Ryu HS, Sohn K, Sands CD, Theophylline disposition in Korean patients with congestive heart failure, in Ann Pharmacother, vol. 28, n. 3, marzo 1994, pp. 396–401, PMID 8193433.
- ^ SP. Hart, Should aminophylline be abandoned in the treatment of acute asthma in adults?, in QJM, vol. 93, n. 11, novembre 2000, pp. 761-5, PMID 11077034.
- ^ Bach JE, Kukanich B, Papich MG, McKiernan BC., Evaluation of the bioavailability and pharmacokinetics of two extended-release theophylline formulations in dogs, in J Am Vet Med Assoc., vol. 224, (7), 1º aprile 2004, pp. 1113-9.
- ^ 5) Adams HR, Veterinary Parmacology and Therapeutics, in Iowa State university press/ames, USA, pp. 542-550.
- ^ Guenther-Yenke CL, McKiernan BC, Papich MG, Powell E., Pharmacokinetics of an extended-release theophylline product in cats, in J Am Vet Med Assoc., vol. 231, (6), 15 settembre 2007, pp. 900-6.
- ^ Carlo Ormas, Re, Soldani et al., Farmacologia Veterinaria, in ed. Idelson-Gnocchi, Italia, pp. 580-592.
- ^ Roncada P, Tomasi L, Montesissa C, Grossi G, Stracciari GL, Anfossi P, Absorption and dosage of theophylline in the horse after single and repeated administration of a microencapsulated preparation, in Equine Vet J., vol. 27, (1), 1995 Jan, pp. 13-8..
- ^ Errecalde JO, Button C, Baggot JD, Mulders MS., Pharmacokinetics and bioavailability of theophylline in horses., in J Vet PharmacolTher, 7(4):, (4), 1984 Dec, pp. 255-63.
- ^ Fantoli U, [Interaction between theophylline and cimetidine], in Recenti Prog Med, vol. 71, n. 3, settembre 1981, pp. 334–5, PMID 7034086.
- ^ Jackson JE, Powell JR, Wandell M, Bentley J, Dorr R, Cimetidine decreases theophylline clearance, in Am. Rev. Respir. Dis., vol. 123, n. 6, giugno 1981, pp. 615–7, PMID 7023306.
- ^ Frank WO, Safety: cimetidine and concomitant theophylline or warfarin--drug interactions and their implications, in Clin Ther, 8 Suppl A, 1986, pp. 57–68, PMID 2878729.
- ^ Phenytoin-theophylline-quinidine interactions, in N. Engl. J. Med., vol. 308, n. 12, marzo 1983, pp. 724–5, DOI:10.1056/NEJM198303243081217, PMID 6828116.
- ^ Marquis JF, Carruthers SG, Spence JD, Brownstone YS, Toogood JH, Phenytoin-theophylline interaction, in N. Engl. J. Med., vol. 307, n. 19, novembre 1982, pp. 1189–90, DOI:10.1056/NEJM198211043071906, PMID 7121545.
- ^ Sessler CN, Cohen MD, Cardiac arrhythmias during theophylline toxicity. A prospective continuous electrocardiographic study, in Chest, vol. 98, n. 3, settembre 1990, pp. 672–8, PMID 2394145.
- ^ Bittar G, Friedman HS, The arrhythmogenicity of theophylline. A multivariate analysis of clinical determinants, in Chest, vol. 99, n. 6, giugno 1991, pp. 1415–20, PMID 2036824.
- ^ Skinner MH, Adverse reactions and interactions with theophylline, in Drug Saf, vol. 5, n. 4, 1990, pp. 275–85, PMID 2198052.
- ^ Sessler CN, Theophylline toxicity: clinical features of 116 consecutive cases, in Am. J. Med., vol. 88, n. 6, giugno 1990, pp. 567–76, PMID 2189301.
- ^ Yoshikawa H, First-line therapy for theophylline-associated seizures, in Acta Neurol. Scand., vol. 115, 4 Suppl, aprile 2007, pp. 57–61, DOI:10.1111/j.1600-0404.2007.00810.x, PMID 17362277.
- ^ a b Seneff M, Scott J, Friedman B, Smith M, Acute theophylline toxicity and the use of esmolol to reverse cardiovascular instability, in Ann Emerg Med, vol. 19, n. 6, giugno 1990, pp. 671–3, PMID 1971502.
- ^ Hendeles L, Weinberger M, Milavetz G, Hill M, Vaughan L, Food-induced "dose-dumping" from a once-a-day theophylline product as a cause of theophylline toxicity, in Chest, vol. 87, n. 6, giugno 1985, pp. 758–65, PMID 3996063.
Voci correlate modifica
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su teofillina
Collegamenti esterni modifica
- teofillina, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) theophylline, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Teofillina, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 3551 · LCCN (EN) sh85134710 · GND (DE) 4059781-7 · J9U (EN, HE) 987007534160605171 |
|---|