Tomografia a emissione di positroni
La tomografia a emissione di positroni (PET, dall'inglese positron emission tomography) è una tecnica diagnostica di imaging biomedico in medicina nucleare.
| Tomografia a emissione di positroni | |
|---|---|
Procedura medica  Una tipica apparecchiatura per la PET | |
| Tipo | Diagnostica medico-nucleare |
| Anestesia | No |
| Classificazione e risorse esterne | |
| ICD-9 | 92.0 |
| MeSH | D049268 |
| MedlinePlus | 003827 |
| Sinonimi | |
| PET | |
La PET dà informazioni di tipo fisiologico permettendo di ottenere mappe dei processi funzionali all'interno del corpo, a differenza della risonanza magnetica nucleare e della tomografia computerizzata, che forniscono informazioni di tipo morfologico. Viene di frequente abbinata alla seconda in un unico esame (PET-TC).
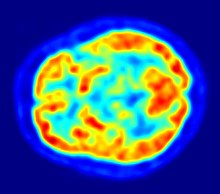
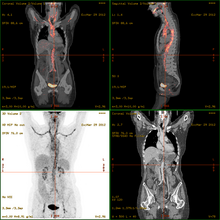
La metodica trova applicazione nella diagnostica di:
- patologie neoplastiche
- demenze e studi di neuroimaging funzionale;
- malattie reumatologiche
- malattie infettive
- malattie cardiache
Descrizione
modificaLa procedura incomincia con l'iniezione di un radiofarmaco formato da un radio-isotopo tracciante con vita media breve, legato chimicamente a una molecola attiva a livello metabolico (vettore). Dopo un certo tempo, durante il quale la molecola metabolicamente attiva (ad esempio il fluorodesossiglucosio: 18F-FDG) raggiunge una determinata concentrazione all'interno dei tessuti organici da analizzare, il paziente viene posizionato nel dispositivo di scansione. Gli atomi dell'isotopo decadono emettendo ciascuno un positrone, che, dopo un percorso massimo di pochi millimetri,[1] si annichila con un elettrone,[2] producendo una coppia di fotoni gamma entrambi di energia 511 keV emessi in direzioni opposte tra loro (fotoni «back to back»).
Questi fotoni sono rilevati quando raggiungono uno scintillatore, dove creano un lampo luminoso, rilevato attraverso dei tubi fotomoltiplicatori. Punto cruciale della tecnica è la rilevazione simultanea di coppie di fotoni: i fotoni che non raggiungono il rilevatore in coppia, cioè entro un intervallo di tempo di pochi nanosecondi, non sono presi in considerazione. Dalla misurazione della posizione in cui i fotoni colpiscono il rilevatore, si può ricostruire l'ipotetica posizione del corpo da cui sono stati emessi, permettendo la determinazione dell'attività o dell'utilizzo chimico all'interno delle parti del corpo investigate.
I modelli più recenti di tomografi immessi in commercio possono migliorare la risoluzione spaziale e di contrasto delle immagini utilizzando durante la loro ricostruzione la correzione per il tempo di volo (Time of Flight o TOF in inglese). Questa correzione tiene conto di quale dei due fotoni di coincidenza interagisce per primo coi rilevatori del tomografo ed è quindi in grado di localizzare in modo più preciso il punto di annichilazione del positrone.
L'ultima innovazione tecnologica riguardante i tomografi è rappresentata dalla PET digitale. Queste macchine permettono di acquisire immagini di migliore qualità (sia in termini di risoluzione spaziale sia di contrasto) somministrando minori attività di radiofarmaco al paziente e riducendo i tempi di acquisizione. Per rilevare i fotoni gamma prodotti dall'annichilazione dei positroni, queste nuove macchine utilizzano dei fotodiodi e dei fotomoltiplicatori al silicio anziché la classica combinazione di cristalli e fotomoltiplicatori, permettendo una conversione diretta dell'energia dei fotoni in segnale elettrico[3].
La densità dell'isotopo nel corpo è poi mostrata all'operatore, sotto forma di immagini di sezioni (generalmente trasverse) separate fra loro di 5 mm circa. La mappa risultante rappresenta i tessuti in cui la molecola campione si è maggiormente concentrata e viene letta e interpretata da uno specialista in medicina nucleare al fine di determinare una diagnosi e il conseguente trattamento.
I radionuclidi utilizzati nella scansione PET sono generalmente isotopi con breve tempo di dimezzamento, come 11C (~20 min), 13N (~10 min), 15O (~2 min) e soprattutto 18F (~110 min). Per via del loro basso tempo di dimezzamento, i radioisotopi devono essere prodotti da un ciclotrone posizionato in prossimità dello scansionatore PET. Questi radionuclidi sono incorporati in composti normalmente assimilati dal corpo umano, come il glucosio, l'acqua o l'ammoniaca, e quindi iniettati nel corpo da analizzare per tracciare i luoghi in cui vengono a distribuirsi. I composti così contrassegnati vengono chiamati radiotraccianti o radiofarmaci.
Valutazione semi-quantitativa della captazione regionale
modificaLa valutazione delle aree ipercaptanti sulle immagini di norma viene fatta in maniera qualitativa da medici esperti; tuttavia esistono dei casi dubbi in cui un'analisi semi-quantitativa può essere utile. Il principale parametro utilizzato in tal senso è il SUV (standardized uptake value) che si può calcolare su ogni area dubbia mediante la seguente formula:
Tale rapporto mostra quante volte capta di più (o di meno) l'area interessata rispetto a quanto capterebbe un'area di uguale massa. Il calcolo del SUV poi può essere ulteriormente corretto per altri parametri, come la superficie corporea o la massa magra. Di solito viene usato nella valutazioni il valore più alto di SUV rilevato a livello delle lesioni studiate (SUVmax). Altri modelli più accurati si basano sull'analisi della cinetica di captazione, rilevata tramite acquisizioni e misurazioni del pool circolante seriate.
Molti studi che valutano la risposta alle terapie citostatiche si avvalgono di misurazioni seriate del SUV sulle lesioni in più scansioni nel tempo, per quantificare la riuscita dei trattamenti. Questo perché la PET ha una risoluzione spaziale minima di un cubo di 5 mm di lato e quindi consente un'ottima valutazione (anche se non garantisce la scomparsa di malattia sotto questo valore), arrivando a fare stime sul singolo grammo di tessuto. Di solito come criterio si considera la riduzione percentuale del valore fra le varie misurazioni, che ovviamente devono essere il più simili possibile come attività somministrata, tempo di acquisizione delle immagini dal momento dell'iniezione e specifiche tecniche della scansione stessa.
Nello studio del linfoma di Hodgkin e dei Linfomi non Hodgkin avidamente captanti l'FDG (compreso il linfoma follicolare), è ormai di uso comune l'utilizzo dei criteri di Deauville per la valutazione della risposta ai trattamenti. Tali criteri si basano sul confronto del SUVmax delle lesioni patologiche con quello rilevato a livello del fegato e dell'aorta. Uno score di 4 o 5 è indice di non risposta ai trattamenti/progressione.[4]
| Score Deauville | Cut-off del SUVmax |
|---|---|
| 1 | Lesione non captante |
| 2 | SUVmax lesione <= SUVmax aortico |
| 3 | SUVmax aortico < SUVmax lesione <= SUVmax fegato |
| 4 | SUVmax lesione > SUVmax fegato |
| 5 | SUVmax lesione > 2-3 volte il SUVmax del fegato o comparsa di nuove sedi di malattia |
Altri criteri proposti per valutare la risposta alla terapia sono i PERCIST (Positron Emission tomography Response Criteria In Solid Tumor). Nell'usare questi criteri si utilizza come variabile il SULpeak (SUV corretto per la massa magra) che viene misurato sulle 5 lesioni più significative dell'esame (massimo 2 per organo) e di grandezza misurabile (almeno 2 centimetri). La malattia viene quindi ristadiata usando i criteri descritti sotto.
| Valutazione PERCIST | Descrizione |
|---|---|
| Risposta metabolica completa | Scomparsa di tutte le lesioni con SULpeak > 2,5 |
| Risposta metabolica parziale | Riduzione dell'attività metabolica di almeno il 30% (media dei valori di tutte le lesioni misurabili) e di almeno 0,8 unità di SUL |
| Progressione metabolica di malattia | Incremento dell'attività metabolica di almeno il 30% (media dei valori di tutte le lesioni misurabili), incremento assoluto di almeno 0,8 unità di SUL, incremento visibile dell'estensione di malattia, comparsa di nuove lesioni di malattia |
| Malattia metabolica stabile | Tutte le condizioni non includibili nei quadri sopra |
Negli ultimi anni si stanno sviluppando delle metodiche che hanno come obiettivo di quantificare la disomogeneità delle lesioni tumorali; tali metodi sono basati sull'analisi delle texture (texture analysis) e sono stati utilizzati inizialmente in ambito radiologico. Spesso lesioni che presentano un uptake di radiofarmaco più disomogeneo sono più aggressive per la maggiore presenza di necrosi o di differenti cloni cellulari al loro interno, come evidenziato dalla correlazione di questi parametri con i dati genetici, molecolari, e istologici (radiomica e radiogenomica).
Il principale difetto dei parametri semiquantitativi rilevabile in PET è la scarsa standardizzazione. Numerosi fattori, non sempre controllabili, infatti influiscono sui risultati (modello del tomografo, parametri di acquisizione, ecc...)
Applicazioni
modificaLa PET è usata estensivamente in oncologia clinica[5] (per avere rappresentazioni dei tumori e per la ricerca di metastasi) e nelle ricerche cardiologiche e neurologiche. Metodi di indagine alternativi sono la tomografia computerizzata a raggi X (TC), l'imaging a risonanza magnetica (MRI), la risonanza magnetica funzionale (RMF) e la tomografia computerizzata a ultrasuoni e a emissione di singolo fotone.
A ogni modo, mentre gli altri metodi di scansione, come la TAC e la RMN permettono di identificare alterazioni organiche e anatomiche nel corpo umano, le scansioni PET sono in grado di rilevare alterazioni a livello biologico molecolare che spesso precedono l'alterazione anatomica, attraverso l'uso di marcatori molecolari che presentano un diverso ritmo di assorbimento a seconda del tessuto interessato. Con una scansione PET è possibile visualizzare e quantificare con discreta precisione il cambio di afflusso sanguigno nelle varie strutture anatomiche (attraverso la misurazione della concentrazione dell'emettitore di positroni iniettato).
Spesso, e sempre più frequentemente, le scansioni della Tomografia a Emissione di Positroni sono raffrontate con le scansioni a Tomografia Computerizzata, fornendo informazioni sia anatomiche e morfologiche, sia metaboliche (in sostanza, su come il tessuto o l'organo siano conformati e su cosa stiano facendo). Per sopperire alle difficoltà tecniche e logistiche conseguenti allo spostamento del paziente per eseguire i due esami e alle imprecisioni conseguenti, ci si avvale oramai esclusivamente dei tomografi PET-TC, nei quali il sistema di rilevazione PET e un tomografo TC di ultima generazione sono assemblati in un unico gantry e controllati da un'unica consolle di comando. L'introduzione del tomografo PET-TC ha consentito un grande miglioramento dell'accuratezza e dell'interpretabilità delle immagini ed una notevole riduzione dei tempi di esame.
La PET gioca un ruolo sempre maggiore nella verifica della risposta alla terapia, specialmente in particolari terapie anti-cancro.[5]
La PET è usata anche in studi pre-clinici sugli animali,[6] dove invece le indagini ripetute sullo stesso soggetto sono consentite. Queste ricerche si sono dimostrate particolarmente valide nella ricerca sul cancro, dove si registra un aumento della qualità statistica dei dati e una sostanziale riduzione del numero di animali richiesti per ogni singolo studio.
Una limitazione alla diffusione della PET è il costo dei ciclotroni per la produzione dei radionuclidi di breve tempo di dimezzamento. Pochi ospedali e Università possono permettersi l'acquisto e il mantenimento di questi costosi apparati e quindi la maggior parte dei centri PET è rifornita da fornitori esterni. Questo vincolo limita l'uso della PET clinica principalmente all'uso di traccianti contrassegnati con il 18F, che avendo un tempo di dimezzamento di 110 minuti può essere trasportato a una distanza ragionevole prima di essere utilizzato. Anche il 68Ga (ottenibile grazie a un generatore) permette di ottenere traccianti in maniera più agevole, mentre il 82Rb è a volte usato per lo studio dell'irrorazione del miocardio.
Uso della PET in neurologia
modificaLa PET cerebrale con FDG permette di valutare il metabolismo glicidico a livello cerebrale ed è utilizzata nella diagnosi delle demenze e nella valutazione del deterioramento cognitivo lieve (MCI Mild Cognitive Impairment).
Mediante ulteriori radiofarmaci è possibile anche eseguire l'imaging della neurotrasmissione (In particolare del sistema dopaminergico. Tale argomento è ampiamente trattato nella relativa voce) o mirato alla ricerca di depositi e placche di beta amiloide nel sospetto di Malattia di Alzheimer.
Sono in studio inoltre dei traccianti specifici per la proteina Tau (sostanza spesso associata a molte patologie neurodegenerative).
Uso della PET in cardiologia
modificaLa tomografia a emissione di positroni è una metodica utilizzata nello studio del cuore (PET cardiaca). Mediante questo tipo di imaging è infatti possibile effettuare sia studi di perfusione (utilizzando ammoniaca marcata con azoto-13, acqua marcata con ossigeno-15 o il rubidio-82) sia di metabolismo (utilizzando il fluorodesossiglucosio). Gli studi di perfusione consentono di localizzare aree del cuore in cui è presente un deficit di irrorazione in seguito ad esempio a fenomeni di arteriosclerosi (con un'accuratezza maggiore rispetto alla scintigrafia miocardica perfusionale), mentre lo studio di metabolismo è utile per la ricerca di miocardio vitale. Per quest'ultima indicazione la PET è considerata la metodica gold standard.
Uso della PET in reumatologia, immunologia e nelle malattie infettive
modificaLa PET con FDG è utilizzata ampiamente nello studio di queste patologie. In particolare per:
- la sarcoidosi
- le osteomieliti dello scheletro appendicolare
- l'osteomielite vertebrale e la spondilodiscite
- la ricerca di foci infettivi in pazienti con febbre di origine sconosciuta o con batteriemia ad alto rischio di infezioni metastatiche
- le vasculiti dei grossi vasi
- valutazione di cisti epatiche o renali potenzialmente infette
- sospetta infezione di device intravascolari (pacemaker e cateteri)
- infezioni associate all'AIDS o alla malattia di Castleman
- valutazione delle lesioni tubercolari
Uso della PET in oncologia
modificaLa PET in oncologia ha le seguenti indicazioni:
- stadiazione e ristadiazione a fine terapia;
- monitoraggio delle terapie antineoplastiche;
- diagnosi differenziale fra benignità o malignità delle lesioni;
- ricerca di tumori primitivi occulti (tumori che hanno già dato metastasi, ma che hanno origine sconosciuta);
- ricerca del miglior punto di una lesione da cui effettuare una biopsia;
- caratterizzazione metabolica delle lesioni neoplastiche;
- pianificazione di trattamenti radioterapici.
I traccianti utilizzabili in oncologia sono molti, ma il più diffuso è il 18fluorodesossiglucosio, cioè glucosio che in posizione 2, invece di un ossidrile, presenta un atomo di fluoro 18 emettitore di positroni. Tale farmaco viene captato di solito in maggior misura dai tessuti neoplastici in quanto sono metabolicamente più attivi (le cellule neoplastiche possono avere un metabolismo fino a 200 volte maggiore rispetto a quelle normali) soprattutto per il fatto che la loro principale via metabolica per il sostentamento energetico è la glicolisi anaerobia.
La PET (con colina) è anche utilizzata in alternativa alla scintigrafia paratiroidea per la ricerca di paratiroidi ipertrofiche o di adenomi paratiroidei nei pazienti affetti da iperparatiroidismo.
Rischi
modificaLa scansione non è invasiva, ma implica l'esposizione a radiazioni ionizzanti. La dose totale di radiazione è significativa, di solito circa 5–7 mSv (milli-sievert). Peraltro, nella pratica moderna, viene quasi sempre utilizzata una scansione combinata di PET/CT , per la quale l'esposizione di radiazione può essere sostanzialmente attorno ai 23–26 mSv (per una persona di 70 kg, la dose è più alta per corpi di maggiore peso).[7] Confrontando tali valori con il livello di classificazione di 6 mSv, attribuito in Gran Bretagna a chi lavora nel campo delle radiazioni, si deve concludere che l'uso della PET necessita di una giustificazione più che sufficiente. Un'analoga comparazione può essere fatta, sempre in Gran Bretagna, anche con la radiazione di fondo media annuale di 2.2 mSv, 0.02 mSv per una radiografia X al torace e 6.5–8 mSv per una scansione del torace, secondo la rivista Chest e ICRP.[8] D'altro canto secondo l'associazione IFALPA, nel 1999 si dichiarò che un operatore di volo riceverebbe una dose annuale di radiazioni di 4–9 mSv.[9]
Note
modifica- ^ Michael E. Phelps, PET: physics, instrumentation, and scanners, Springer, 2006, pp. 8–10.
- ^ PET Imaging, su medcyclopaedia.com, GE Healthcare. URL consultato il 10 novembre 2010 (archiviato dall'url originale il 4 maggio 2012).
- ^ Advanced Functional Tumor Imaging and Precision Nuclear Medicine Enabled by Digital PET Technologies - PMC
- ^ AA.VV., Fondamenti di Medicina Nucleare, Springer, p. 768-771.
- ^ a b Young H, Baum R, Cremerius U, et al., Measurement of clinical and subclinical tumour response using [18F]-fluorodeoxyglucose and positron emission tomography: review and 1999 EORTC recommendations., in European Journal of Cancer, vol. 35, n. 13, 1999, pp. 1773–1782, DOI:10.1016/S0959-8049(99)00229-4, PMID 10673991.
- ^ Rat Conscious Animal PET Archiviato il 5 marzo 2012 in Internet Archive.
- ^ Brix G, Lechel U, Glatting G, et al., Radiation exposure of patients undergoing whole-body dual-modality 18F-FDG PET/CT examinations, in J. Nucl. Med., vol. 46, n. 4, aprile 2005, pp. 608–13, PMID 15809483.
- ^ de Jong PA, Tiddens HA, Lequin MH, Robinson TE, Brody AS, Estimation of the radiation dose from CT in cystic fibrosis, in Chest, vol. 133, n. 5, maggio 2008, pp. 1289–91; author reply 1290–1, DOI:10.1378/chest.07-2840, PMID 18460535.
- ^ Air crew radiation exposure—An overview Archiviato il 12 giugno 2011 in Internet Archive., Susan Bailey, Nuclear News (a publication of American Nuclear Society), January 2000.
Bibliografia
modifica- Maurizio Dondi e Raffaele Giubbini, Medicina nucleare nella pratica clinica, 2003, ISBN 88-555-2728-2.
- Duccio Volterrani, Paola Anna Erba e Giuliano Mariano, Fondamenti di medicina nucleare. Tecniche e applicazioni, Springer Verlag, 2010, ISBN 9788847016842.
- (EN) Francesco Signorelli e Domenico Chirchiglia, FDG-PET Imaging in Neurodegenerative Brain Diseases, ISBN 978-953-51-1160-3, 19 giugno 2013
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su tomografia a emissione di positroni
Collegamenti esterni
modifica- (EN) positron emission tomography, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Linee Guida della regione Emilia-Romagna per l'uso appropriato della FDG PET in oncologia.
- Presentazione al Congresso Nazionale AIMN (Associazione Italiana di Medicina Nucleare) Rimini 2015 sulla quantificazione con FDG PET della risposta alle terapie in oncologia
- (EN) Review sulla Texture Analysis in PET
- (EN) Linee Guida Dell'European Association of Nuclear Medicine (EAMN) sull'uso della FDG PET nello studio delle infezioni e delle infiammazioni.
- Imaging Atlas of PET-CT, su med.harvard.edu. URL consultato il 21 gennaio 2006 (archiviato dall'url originale l'11 maggio 2019).
- Nuclear Medicine Information, su nucmedinfo.com.
- Introduction to PET Physics, su depts.washington.edu. URL consultato il 4 maggio 2019 (archiviato dall'url originale il 24 febbraio 2019).
- GE HealthCare, Philips, Siemens Archiviato il 13 gennaio 2006 in Internet Archive. - Major manufacturers of PET scanners
- Thompson Cancer Survival Research Center info on PET, su thompsonpet.com. URL consultato il 21 gennaio 2006 (archiviato dall'url originale il 26 dicembre 2005).
- What is PET?, su radiologyinfo.org.
| Controllo di autorità | Thesaurus BNCF 54010 · LCCN (EN) sh85135956 · GND (DE) 4129799-4 · J9U (EN, HE) 987007541475505171 |
|---|