Chlamydomonas reinhardtii
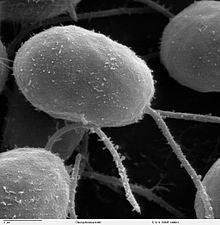
Chlamydomonas reinhardtii è un'alga eucariote unicellulare, di circa 10 µm di diametro, che si muove servendosi di due flagelli (lunghi circa 10 µm). Va precisato che non ha nulla a che fare con il batterio Chlamydia trachomatis, responsabile della nota malattia venerea.
| Chlamydomonas reinhardtii | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Eukaryota |
| Regno | Plantae |
| Phylum | Chlorophyta |
| Classe | Chlorophyceae |
| Ordine | Chlamydomonadales |
| Famiglia | Chlamydomonadaceae |
| Genere | Chlamydomonas |
| Specie | C. reinhardtii |
| Nomenclatura binomiale | |
| Chlamydomonas reinhardtii P.A.Dang. | |
Caratteristiche e ciclo vitale modifica
C.reinhardtii è molto presente nel suolo e nei bacini di acqua dolce. Presenta una parete cellulare, un ampio cloroplasto ed un apparato sensibile alla luce, detto eyespot[1]. In genere le varie specie di Chlamydomonas possono essere coltivate in un terreno minimo (con sali inorganici) in presenza di luce (per avviare la fotosintesi). Se somministrato acido acetico, possono crescere anche al buio.
C.reinhardtii è presente per la maggior parte sotto forma di cellule vegetative flagellate, aploidi, con 17 piccoli cromosomi (per un genoma di circa 100 milioni di paia di basi). Se le cellule perdono la fonte di azoto, si formano gameti aploidi. Ci sono due tipi sessuali, identici all'osservazione, chiamati mt(+) e mt(-), che possono fondere e formare uno zigote diploide. Lo zigote non è flagellato, ma rimane dormiente nel suolo: se esposto alla luce, può andare incontro alla meiosi, rilasciando quattro cellule aploidi flagellate, che riprendono la fase vegetativa.
C.reinhardtii è spesso chiamato lievito verde, dal momento che è fotosintetico (e quindi autotrofo), ma presenta caratteristiche molto simili a quelli dei lieviti (come Saccharomyces cerevisiae). Forma agevolmente colonie su piastra, presenta due tipi sessuali (può crescere sia in forma aploide che diploide), permette l'analisi delle tetradi (scoperte proprio in Chlamydomonas) durante la riproduzione e ha una crescita molto rapida (una generazione dura circa 5 ore). In condizioni di crescita ottimali, la cellula può andare incontro anche a due o tre mitosi prima che le cellule figlie vengano rilasciate all'esterno della parete della cellula madre. All'analisi dell'osservatore, così, da un singolo evento riproduttivo sembrano essere prodotte 4-8 cellule figlie.
C.reinhardtii come organismo modello modifica
La linea cellulare considerata wild-type per l'organismo è chiamata c137 ed è di tipo sessuale mt+. La sua origine non è certa, ma si crede che sia stata raccolta in un campo nel New England negli anni quaranta. Sono noti molti mutanti di C. reinhardtii. I mutanti sono uno strumento utile per studiare un gran numero di processi biologici, come:
- il movimento attraverso flagelli e la regolazione della loro lunghezza;
- la risposta della cellula agli stimoli luminosi;
- i meccanismi di riconoscimento tra due o più cellule;
- la regolazione dell'espressione genica;
- la formazione e l'eredità del cloroplasto;
- la risposta alle variazioni di concentrazione dei sali inorganici presenti;
- qualsiasi processo produttivo.
Per questi motivi, C.reinhardtii è un organismo modello che sta raccogliendo sempre più successo nella comunità scientifica: questa alga è diventato infatti un piccolo caso scientifico, con oltre 100 grandi laboratori nel mondo che hanno iniziato ad usarlo nel giro di pochi anni. La sua attrattiva è aumentata ulteriormente in seguito alla pubblicazione di dati riguardanti il suo genoma. Una prima parte di esso, infatti, è stato diffuso nel febbraio 2003 dal Joint Genome Institute del Dipartimento dell'Energia americano. Sono disponibili le sequenze del genoma nucleare dell'organismo, quasi interamente completato, e quelle dei suoi mitocondri (~15.8 Kb) e dei cloroplasti (~200 Kb). È inoltre disponibile un grande numero di cDNA di sequenze espresse e di ESTs.
Negli studi di microfluidità, C.reinhardtii è l'archetipo del nuotatore "puller", ossia di quel tipo di microorganismi che, per nuotare, tirano il fluido verso di sé.[2]
Trasformazione di C. reinhardtii modifica
C. reinhardtii è un organismo molto maneggevole in laboratorio: ciò rende possibili numerose applicazioni biotecnologiche. È infatti un organismo molto semplice da trasformare: la trasformazione può avvenire attraverso ricombinazione omologa nel cloroplasto e non omologa nel nucleo. Il DNA nucleare viene comunemente trasformato attraverso elettroporazione. Il genoma del cloroplasto può essere trasformato, invece, attraverso un approccio biobalistico, sparando microproiettili di DNA nell'organello. Tali procedure rappresentano infatti la via più efficiente di trasformazione del cloroplasto. Ciò è probabilmente dovuto al fatto che il cloroplasto occupa più della metà del volume della cellula, fornendo così al proiettile un bersaglio molto ampio.
C. reinhardtii come fonte pulita di idrogeno modifica
Grazie anche alle sue caratteristiche di organismo modello per la genetica, numerosi sono i campi di ricerca che utilizzano questo microrganismo al fine di comprendere diversi processi biologici. Uno dei più promettenti è quello legato alla produzione di idrogeno, che prevede minime quantità di gas serra quali l'anidride carbonica. Infatti, qualora fosse possibile utilizzare la microalga per la produzione di grandi quantità di idrogeno a fini energetici tale sintesi richiederebbe sostanzialmente le due risorse energetiche primarie sulla terra: l'acqua e la luce.
Già nel 1939 il ricercatore tedesco Hans Gaffron (1902-1979), allora alla University of Chicago, descrisse il metabolismo dell'idrogeno nelle alghe verdi unicellulari, scoprendo in quel caso la capacità da parte delle cellule di consumare l'idrogeno. Più tardi (1942), lo stesso Gaffron scoprì che interrompendo la produzione fotosintetica di ossigeno temporaneamente, le alghe verdi erano in grado di attivare la produzione di idrogeno per un breve periodo prima che la produzione di ossigeno si ristabilisse. Tale reazione, catalizzata da una ferro-idrogenasi, avviene esclusivamente in anaerobiosi, condizione assolutamente necessaria in quanto l'enzima è estremamente sensibile all'ossigeno. Questo elemento, infatti, è in grado di inibirne sia il sito attivo dell'enzima che la sua espressione genica. Dal punto di vista biologico, la produzione di idrogeno sembra essere essenzialmente una valvola di sfogo per la cellula che, in assenza di ossigeno, si trova ad avere un eccessivo numero di elettroni presso i cloroplasti, scartandoli anche attraverso l'attività della idrogenasi. Questo permette alla cellula di preservare la funzionalità del "motore" fotosintetico, salvandolo da un eccesso di potere riducente, e sintetizzando al contempo ATP, la principale fonte di energia utilizzata a livello cellulare.
Nei trent'anni successivi alla scoperta, molti ricercatori hanno cercato di chiarire ulteriormente i meccanismi che regolano la produzione di idrogeno da parte delle alghe. Negli ultimi anni, in particolare, il rinnovato interesse per le fonti energetiche rinnovabili ha dato ulteriore impulso alla ricerca in questo ambito, portando alla messa a punto di un primo metodo per rendere efficiente la produzione di idrogeno in C. reinhardtii. La metodica, descritta nel 2000 da Anastasios Melis dell'Università di Berkeley (California, USA), consiste nel privare il mezzo di coltura dello zolfo, un elemento fondamentale per il fotosistema II responsabile della fotolisi dell'acqua. Questa deprivazione porta, nel giro di circa 24 ore, ad una riduzione drastica della fotosintesi e, quindi, della produzione di ossigeno, fino a raggiungere le condizioni di anaerobiosi necessarie per attivare la produzione di idrogeno.[3]. In queste condizioni, la coltura algale si trova in anaerobiosi alla luce, una situazione che permette non solo la sintesi dell'idrogenasi, ma anche un flusso costante di elettroni all'enzima stesso dovuto alla luce, che viene raccolta dai pigmenti che normalmente garantiscono la fotosintesi.
In ogni caso, la durata della sintesi di idrogeno resta un fattore limitante per eventuali produzioni su larga scala a partire dal microorganismo. Il principale motivo di tale brevità è legato al fatto che nel caso della deprivazione di zolfo, la produzione di idrogeno dura al massimo una settimana, portando infine alla morte cellulare. Nel caso si utilizzi un mezzo di coltura completo, ovvero nelle condizioni in cui Gaffron e Rubin per primi osservarono questo fenomeno (1942), la produzione può durare da qualche minuto ad un'ora circa, dopo i quali la cellula è in grado di ripristinare la fotosintesi (e dunque la produzione di ossigeno).
Per risolvere la questione, attualmente si stanno seguendo diverse strategie, fra le quali:
- la resistenza dell'idrogenasi all'ossigeno. In tal modo, l'accumulo di ossigeno non comprometterebbe più la funzionalità dell'enzima. Ciò renderebbe possibile una continua produzione di idrogeno sfruttando pienamente la fotosintesi[4].
- la riduzione della competitività con altri enzimi. Sebbene un enzima insensibile all'ossigeno possa garantire l'utilizzo di una piena fotosintesi, determinando un aumento della produttività rispetto ai tassi attuali, questa soluzione non risolverebbe la competitività dell'idrogenasi con gli altri enzimi che normalmente ricevono gli elettroni della fotosintesi, quali ad esempio la Rubisco, responsabile del ciclo di Calvin, la quale agisce come principale accettore di elettroni rispetto all'idrogenasi. Questa soluzione, infatti, dovrebbe essere condotta in parallelo ad una serie di modifiche di tipo genetico o fisiologico in grado di ridurre il rifornimento di elettroni alle altre vie metaboliche, garantendo infine un rifornimento maggiore alla sola idrogenasi.
- la sospensione temporanea, attraverso manipolazione genetica della idrogenasi, di vie metaboliche specifiche. Tale approccio intende rendere possibile, con una stessa coltura algale, accendere e spegnere l'espressione di determinati geni funzionali al processo, alternando fasi di aerobiosi e di anaerobiosi, ritardando sensibilmente il momento della morte cellulare e del ricambio della coltura. Nel caso della fotosintesi, ciò impedirebbe all'ossigeno di raggiungere un livello tale da inibire la produzione di idrogeno.[5]. Nel caso dell'idrogenasi, la soppressione mirata della sua espressione permetterebbe alla coltura di tornare ad un processo di crescita fisiologico in modo da ristabilire delle condizioni di salute ottimali in vista di una nuova fase di stress durante la quale evolvere nuovamente idrogeno. Recentemente, un sistema inducibile dell'espressione genica di Chlamydomonas è stato pubblicato[6] e https://www.google.it/patents?hl=it&lr=&vid=USPATAPP12920245&id=pzonAQAAEBAJ&oi=fnd&dq=inducible+system+chlamydomonas+giovanni+giuliano&printsec=abstract[collegamento interrotto] da un gruppo di ricerca italiano dell'ENEA di Roma.
Con ogni probabilità, nessuno di questi approcci riuscirà individualmente a risolvere il problema dell'aumento di produttività di idrogeno in C. reinhardtii, mentre una integrazione funzionale fra loro potrebbe portare ad un significativo miglioramento dei risultati attuali. In questo senso, la produzione industriale di idrogeno per via biofotolitica a partire da microalghe non pare essere nel prossimo futuro. In teoria, la massima efficienza di conversione energetica della luce in prodotti del metabolismo in organismi fotosintetici è del 10% considerando la completa radiazione luminosa (20% se si considera solo lo spettro della luce visibile). I migliori risultati prodotti in laboratorio, dunque con luce artificiale, sono di poco superiori al 3%, e sono stati recentemente pubblicati da un gruppo italiano del CNR di Firenze. Ad ogni modo, la prima produzione di idrogeno con alghe verdi condotta con luce solare, pubblicata dallo stesso gruppo, a parte dimostrare la possibilità di condurre questo processo con luce solare, ha anche riportato una notevole riduzione della produttività. A questo proposito, lo studio di fotobioreattori efficienti ed a basso costo, dedicati specificamente a questo processo, è un elemento essenziale per la futuribilità e la riproduzione industriale di questa biotecnologia.
Note modifica
- ^ (EN) Mark D. Thompson, Telsa M. Mittelmeier e Carol L. Dieckmann, Chlamydomonas: Molecular Genetics and Physiology, collana Microbiology Monographs, Springer International Publishing, 2017, pp. 257–281, DOI:10.1007/978-3-319-66365-4_9, ISBN 9783319663654. URL consultato il 12 luglio 2019.
- ^ (EN) David Saintillan, Rheology of Active Fluids, in Annual Review of Fluid Mechanics, vol. 50, n. 1, 5 gennaio 2018, pp. 563–592, DOI:10.1146/annurev-fluid-010816-060049. URL consultato il 9 luglio 2021.
- ^ Anastasios Melis, Thomas Happe, Trails of green alga hydrogen research - from Hans gaffron to new frontiers (PDF), in Photosynthesis Research, vol. 80, 2004, pp. 401–409, DOI:10.1023/B:PRES.0000030421.31730.cb.
- ^ Laurent Cournac, Florence Musa, Laetitia Bernarda, Geneviève Guedeneya, Paulette Vignaisb and Gilles Peltie, Limiting steps of hydrogen production in Chlamydomonas reinhardtii and Synechocystis PCC 6803 as analysed by light-induced gas exchange transients, in International Journal of Hydrogen Energy, vol. 27, n. 11/12, 2002, pp. 1229–1237, DOI:10.1016/S0360-3199(02)00105-2.
- ^ Anastasios Melis, Hydrogen and hydrocarbon biofuels production via microalgal photosynthesis, su epmb.berkeley.edu. URL consultato il 7 aprile 2008 (archiviato dall'url originale il 3 aprile 2008).
- ^ (EN) Paola Ferrante, Claudia Catalanotti, Giulia Bonente, Giovanni Giuliano, An Optimized, Chemically Regulated Gene Expression System for Chlamydomonas, su dx.plos.org. URL consultato il 17 maggio 2021 (archiviato dall'url originale il 7 febbraio 2020).
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Chlamydomonas reinhardtii
- Wikispecies contiene informazioni su Chlamydomonas reinhardtii
Collegamenti esterni modifica
- Decodificato il genoma della Chlamydomonas reinhardtii, su Galileo, 12 ottobre 2007. URL consultato il 17 maggio 2021 (archiviato dall'url originale il 10 marzo 2016).
- (EN) Domande comuni su Chlamydomonas reinhardtii, su yale.edu. URL consultato il 23 febbraio 2007 (archiviato dall'url originale il 23 febbraio 2007).
- (EN) Chlamy.org: banca dati della Duke University contenente informazioni genomiche, genetiche, bibliografiche su Chlamydomonas e sulle sue colture cellulari, su chlamy.org.
- (EN) Sito su C.reinhardtii orientato all'insegnamento, su chlamyteach.info. URL consultato il 5 marzo 2007 (archiviato dall'url originale il 24 aprile 2006).
| Controllo di autorità | J9U (EN, HE) 987007551359005171 |
|---|
