Fotorecettore
I fotorecettori sono neuroni specializzati che si trovano sulla retina. La luce che arriva sul fondo dell'occhio viene "tradotta" in segnali bioelettrici che giungono al cervello attraverso il nervo ottico.
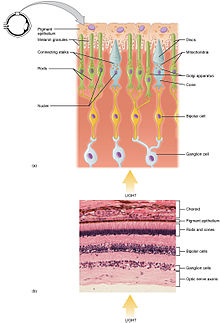
I fotorecettori sono di due tipi: coni e bastoncelli. I coni si concentrano nella zona centrale della retina (la fovea) e sono deputati alla visione dei colori (fotopica) e alla visione distinta; ne esistono almeno tre tipi diversi, rispettivamente per il rosso, il verde e il blu (se ne contano circa 6 milioni per occhio). I bastoncelli, invece, sono più sensibili al movimento, sono impiegati per la visione al buio (scotopica) e si concentrano nella zona periferica della retina. Coni e bastoncelli presentano una diversa sensibilità alla luce riconducibile alla rispettiva organizzazione del lavoro. Il lavoro dei coni è individuale nel senso che ciascuno di essi genera un impulso che è avviato al cervello indipendentemente. Nel caso dei bastoncelli, invece, diverse migliaia di elementi convergono su un singolo interneurone e l'impulso che viene avviato al cervello emerge dalla sommatoria di tutti i singoli impulsi. I bastoncelli risultano così circa 4000 volte più sensibili alla luce rispetto ai coni.
Nella struttura dei fotorecettori si possono identificare tre parti:
1) un segmento esterno: caratterizzato da strutture membranose (chiamate "dischi"), su cui sono posizionati i pigmenti che reagiscono allo stimolo dei fotoni (luce che arriva in "pacchetti" detti quanti). Questa parte è in contatto con l'epitelio pigmentato, lo strato più esterno della retina che contiene un'elevata quantità di melanina per assorbire la luce che non è stata trattenuta dalla retina. Inoltre, ha la funzione di risintetizzare i pigmenti visivi e di facilitare il ricambio dei dischi.
2) segmento interno: caratterizzato dalla presenza degli organelli interni come mitocondri, apparati di Golgi, ecc., indispensabili per il metabolismo cellulare e il nucleo.
3) terminazione sinaptica: permette la trasmissione dei segnali dal fotorecettore alle cellule bipolari mediante sinapsi ossia per trasmissione biochimica tra cellule nervose (grazie a molecole dette neurotrasmettitori).
Meccanismo di trasduzione modifica
Nei bastoncelli l'assorbimento dei fotoni avviene grazie alla rodopsina, una molecola composta da una struttura proteica, all'opsina e a un cromoforo retinale. L'opsina è una proteina che lega la molecola di retinale a livello dell'ultimo segmento transmembrana. L'arrivo del fotone modifica la struttura del retinale per rotazione della catena terminale connessa all'opsina, passando quindi dalla forma 11-cis retinale alla forma tutto-trans. La molecola di rodopsina viene così trasformata prima in metarodopsina I e poi in metarodopsina II. Quest'ultima va ad attivare la subunità alfa della proteina G Trasducina che attiverà una particolare fosfodiesterasi PDE; La fosfodiesterasi andrà a idrolizzare il GMPc in GMP e questo causerà la chiusura di particolari canali presenti nella membrana dei fotorecettori detti canali CNG la cui probabilità di apertura dipende, appunto dalla concentrazione di nucleotidi ciclici. I canali CNG sono permeabili agli ioni sodio e calcio (quest'ultimo costituisce circa un settimo della corrente in entrata di questi canali); la chiusura di questi canali causerà un'iperpolarizzazione dei fotorecettori che attraverso un potenziale graduato andrà a limitare l'esocitosi di neurotrasmettitori nella terminazione sinaptica.
Caratteristica dei recettori dei vertebrati è quella di non rispondere allo stimolo tramite una depolarizzazione, ma tramite un'iperpolarizzazione. Infatti, in condizioni normali, la membrana del segmento esterno ha un potenziale di membrana più basso rispetto a quello degli altri neuroni in genere di -40 mV, il che determina la presenza di correnti elettrotoniche che depolarizzano anche la membrana presinaptica.
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su fotorecettore
Collegamenti esterni modifica
- (EN) photoreceptor, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 36922 · LCCN (EN) sh85101407 · GND (DE) 4045934-2 · BNF (FR) cb16755836n (data) · J9U (EN, HE) 987007543628405171 |
|---|