Legame quadruplo
Un legame quadruplo è un legame chimico tra due atomi che coinvolge otto elettroni. Questo legame costituisce una estensione dei concetti familiari di legame doppio e triplo.[1] Legami quadrupli stabili sono più comuni nei metalli che stanno verso il centro della serie di transizione, e cioè renio, tungsteno, molibdeno e cromo. Di solito i leganti che favoriscono la formazione del legame quadruplo non sono π-accettori, ma sono π-donatori.
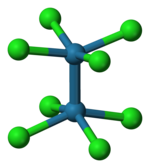
L'acetato di cromo(II), Cr2(μ-O2CMe)4(H2O)2, è stato il primo composto contenente un legame quadruplo ad essere sintetizzato. Fu descritto nel 1844 da Eugène-Melchior Péligot, anche se il suo particolare tipo di legame non fu riconosciuto per più di un secolo.[2] Il primo composto nel quale fu caratterizzato il legame quadruplo è stato invece l'octaclorodireniato(III) di potassio, K2[Re2Cl8]·2H2O, in seguito a ricerche di F. A. Cotton nel 1964.[3] In questo composto la distanza di legame Re–Re è solo 224 pm. Secondo la teoria degli orbitali molecolari il legame è descritto come σ2π4δ2 cioè come un legame sigma, due legami pi greco e un legame δ.
Sono stati descritti molti altri composti con legami quadrupli, soprattutto da Cotton e collaboratori. L'anione [Mo2Cl8]4- contenuto nel sale octaclorodimolibdato(II) di potassio, K4[Mo2Cl8], è isoelettronico con l'anione [Re2Cl8]2- nel sale di direnio.[4] Un esempio di composto di ditungsteno con un legame quadruplo è [W2(hpp)4Cl2] (hpp = esaidropirimidopirimidina).[5]

Note modifica
- ^ U. Radius, F. Breher, To boldly pass the metal-metal quadruple bond, in Angew. Chem. Int. Ed., vol. 45, n. 19, 2006, pp. 3006-3010, DOI:10.1002/anie.200504322. URL consultato il 24 marzo 2011.
- ^ F. A. Cotton, R. A. Walton, Multiple bonds between metal atoms, Oxford, Oxford, 1993, ISBN 0-19-855649-7.
- ^ F. A. Cotton, C. B. Harris, The crystal and molecular structure of dipotassium octachlorodirhenate(III) dihydrate, K2[Re2Cl8]2H2O, in Inorg. Chem., vol. 4, n. 3, 1965, pp. 330–333, DOI:10.1021/ic50025a015. URL consultato il 24 marzo 2011.
- ^ G. S. Girolami, T. B. Rauchfuss, R. J. Angelici, Synthesis and technique in inorganic chemistry, Mill Valley, CA, University Science Books, 1999, ISBN 0-935702-48-2.
- ^ F. A. Cotton, J. P. Donahue, D. L. Lichtenberger, C. A. Murillo, D. Villagrá, Expeditious access to the most easily ionized closed-shell molecule, W2(hpp)4, in J. Am. Chem. Soc., vol. 127, n. 31, 2005, pp. 10808–10809, DOI:10.1021/ja0535458. URL consultato il 24 marzo 2011.
Collegamenti esterni modifica
- (EN) quadruple bond, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.