Numero di massa
Il numero di massa (indicato con A, dalla parola tedesca Atomgewicht [peso atomico][1]) è pari al numero di nucleoni (neutroni e protoni) presenti nel nucleo di un atomo.[2][3]
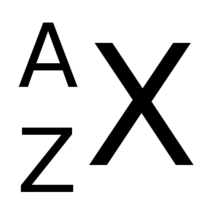
Quando di un elemento si vuole specificare il numero di massa, lo si scrive in alto (in posizione apice), a sinistra del simbolo chimico.[3] Ad esempio, per l'atomo del carbonio con numero di massa 12, si rappresenta la somma dei suoi 6 protoni e dei rispettivi 6 neutroni: 12C. Nuclidi diversi con lo stesso numero di massa vengono detti isobari: un esempio di nuclidi isobari è costituito dal 12C e dal 12B.
Numero di massa e massa dei nucleoni modifica
Poiché le masse di neutroni e protoni non legati sono circa pari a 1 uma, in prima approssimazione il valore del numero di massa può essere considerato uguale in termini numerici al valore della somma delle masse in uma dei neutroni e dei protoni. Sebbene tali valori siano quasi identici numericamente, non è però corretto esprimere il numero di massa in termini di massa in uma di neutroni + protoni, in quanto il numero di massa è un numero adimensionale, mentre la massa di neutroni e protoni non è un numero adimensionale (infatti ha le dimensioni di una massa).
Inoltre, il numero di massa è sempre identificato da un numero naturale (cioè un numero intero positivo), mentre la massa dei nucleoni in uma, che possiamo approssimare alla massa atomica (essendo la massa degli elettroni trascurabile rispetto alla massa dei nucleoni), è rappresentata da un numero reale. Ad esempio la massa atomica del 24Mg è pari a circa 23,985 uma, mentre il suo numero di massa è pari a 24.[3]
Note modifica
- ^ Jensen e William B., The Origins of the Symbols A and Z for Atomic Weight and Number (PDF), in J. Chem. Educ, vol. 82, n. 1764. URL consultato il 7 maggio 2021 (archiviato dall'url originale il 2 dicembre 2020).
- ^ Definizione IUPAC del "numero di massa"
- ^ a b c Silvestroni, p. 584.
Bibliografia modifica
- Paolo Silvestroni, Fondamenti di chimica, 10ª ed., CEA, 1996, ISBN 88-408-0998-8.
Voci correlate modifica
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «numero di massa»
Collegamenti esterni modifica
- (EN) mass number, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.