Ponte salino
Il ponte salino è un dispositivo che permette di mantenere l'elettroneutralità in una cella elettrochimica, collegando le due semicelle in cui avvengono rispettivamente l'ossidazione e la riduzione. È generalmente costituito da un qualsivoglia mezzo ionico munito di una barriera semipermeabile (setto di vetro poroso) a ciascuna estremità. La barriera consente il passaggio di piccole molecole e ioni, ma non di molecole più grandi.
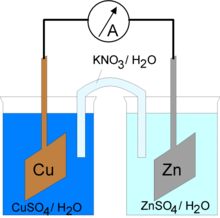
Solitamente si costituisce di un tubo cavo ad U in vetro imbottito di un elettrolita solido (generalmente NH4NO3, KNO3, KCl, Na2SO4 o NaCl)[1] o di un sale disciolto in una sostanza gelatinosa (nel maggiore dei casi l'agar agar) e tappato alle estremità con dei setti porosi (costituiti ad esempio da polvere di vetro sinterizzata, carta o cotone).[1] Comuni sono anche i ponti salini realizzati con carta da filtro, accoppiata anch'essa con degli elettroliti inerti.
Il ponte salino permette il libero scambio di ioni dall'interno all'esterno del tubo senza che le soluzioni delle semicelle entrino in contatto tra di loro, cosa che darebbe vita a interazioni che comprometterebbero il regolare funzionamento della pila. Grazie al ponte salino è possibile mantenere neutre le semicelle, consentendo la perpetuazione di reazioni di ossido-riduzione senza il pericolo di arrivare alla saturazione.
Note modifica
- ^ a b Elettrochimica (PDF), su chimica.unipd.it. URL consultato il 18 ottobre 2010 (archiviato dall'url originale il 30 maggio 2009).
Voci correlate modifica
Collegamenti esterni modifica
- (EN) salt bridge, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.