Resorcinolo
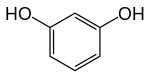
Resorcinolo o m-idrochinone è il nome comune, raccomandato dalla IUPAC,[2] per l'isomero 1,3 del benzendiolo, un composto chimico appartenente ai fenoli. È conosciuto anche con altri nomi, come resorcina, m-diidrossibenzene e metadifenolo.
| Resorcinolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,3-diidrossibenzene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H4(OH)2 |
| Massa molecolare (u) | 110,11 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 203-585-2 |
| PubChem | 5054 |
| DrugBank | DB11085 |
| SMILES | C1=CC(=CC(=C1)O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | ~ 1,28 (20 °C) |
| Solubilità in acqua | 1000 g/l (20 °C) |
| Temperatura di fusione | 109 °C (382 K) |
| Temperatura di ebollizione | 281 °C (554 K) (1013 hPa) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 171 °C (444 K) |
| Temperatura di autoignizione | 605 °C (878 K) |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 302 - 315 - 319 - 400 |
| Consigli P | 273 - 302+352 - 305+351+338 [1] |
A temperatura ambiente si presenta come un solido cristallino bianco-trasparente, sapore dolciastro e dall'odore sgradevole. È un composto nocivo, irritante, pericoloso per l'ambiente.
La resorcina deve il suo nome alla somiglianza con l'orcina e al fatto che fu ottenuta per la prima volta (Hlasiwetz e Barth, 1864), fondendo alcune resine con alcali.[3]
Produzione modifica
Si ottiene da fonti naturali tramite la distillazione di legni tropicali, o dal trattamento con soda di alcune resine ed essudati vegetali (galbano, assafetida).
Sinteticamente si produce fondendo con carbonato di potassio derivati benzenici quali il 3-iodofenolo, l'acido 3-fenolsolfonico, l'acido 1,3-benzendisolfonico. Anche altri composti benzenici orto- e para- sostituiti quali i bromofenoli, se fusi con idrossido di potassio generano resorcinolo.
Dagli amminofenoli si ottiene per azione di acido nitroso e seguente idrolisi. Mentre dal 1,3-diaminobenzene si ottiene per azione dell'acido cloridrico[4].
Proprietà modifica
La resorcina cristallizza in aghi incolori, di sapore dolciastro-acre, facilmente solubili in acqua, alcool ed etere, ma insolubili in cloroformio e disolfuro di carbonio. Se esposti all'aria i cristalli si colorano di rosa. La resorcina è una sostanza riducente: riduce il reattivo di Fehling e l'argento ammoniacale. Non forma un precipitato con la soluzione diacetato di piombo né con il pirocatecolo. Con cloruro di ferro (III) si colora di viola scuro. Con l'acqua di bromo dà tribromoresorcina. Con acido nitrico concentrato produce trinitroresorcina o acido stifnico, materia colorante gialla, che esplode in seguito a riscaldamento. Grazie a queste proprietà viene usato come agente colorante per alcuni esperimenti di cromatografia. L'amalgama di sodio lo riduce a diidroresorcina, che se riscaldata a 150-160 °C con una soluzione concentrata di idrossido di bario dà acido γ-acetilbutirrico (D. Vorlgnder). Se fusa con l'idrossido di potassio, la resorcina produce floroglucinolo, pirocatecolo e diresorcina. Condensa in ossichetoni con acidi o con acidi cloridrici, in presenza di agenti disidratanti, ad esempio con cloruro di zinco e acido acetico a 145 °C produce resacetofenone.[5] Con le anidridi di acidi dibasici produce fluorescine. Se riscaldata con cloruro di calcio - ammoniaca a 200 °C produce meta-diossifenilammina.[6] Con il nitrito di sodio da una colorazione blu idrosolubile, che diventa rossa se trattata con acidi, usata come indicatore per il pH sotto il nome di Lacmoid.[7] Si condensa facilmente con le aldeidi: con formaldeide in presenza di acido cloridrico come catalizzatore origina metilen diresorcina [(HO)2C6H3]2CH2. La reazione con il cloralio idrato in presenza di bisolfato di potassio produce il lattone dell'acido tetra-ossidifenil metano carbossilico.[8] In soluzione alcolica si condensa con l'acetoacetato di sodio per formare il 4-metilumbelliferone.[9]
Usi modifica
Medicina modifica
Il resorcinolo è uno dei principali fenoli naturali dell'olio di argan.[10] Per le sue proprietà antisettiche è usato in preparazioni dermatologiche, tra le quali è molto diffuso l'antimicotico per uso topico noto come fucsina fenica.
Nei prodotti estetici per il peeling (pasta di Pascher e pasta di Letessier), dal 30% minimo. A tale concentrazione il resorcinolo provoca il distacco in toto dello strato corneo ma anche effetti collaterali irritativi o di vasodilatazione; è usato anche come schiarente e depigmentante, di solito in concentrazione 1 %, in sostituzione dell'idrochinone. È presente nei trattamenti topici contro l'acne, al 2% circa e nei trattamenti sotto prescrizione medica a concentrazioni più elevate.[11]
Chimica modifica
La resorcina è usato come intermedio chimico per la sintesi di farmaci e altri composti organici. In soluzione al 2% acidificata con H2SO4 costituisce il Reattivo di Mohler, utilizzato nell'analisi dello ione tartrato.
Viene utilizzata nella produzione di coloranti e plastificanti diazoici e come assorbente Uv. Per esempio viene impiegata nella formulazione di collanti per poliammidi, miscelata con solventi idonei quali ad esempio il metanolo, in concentrazioni variabili dal 30% al 50%.
Come intermedio per la produzione di sostanze coloranti, quali ad esempio la fluoresceina ed il verde mordente C.I. 10000.
Il resorcinolo è un reagente analitico per la determinazione qualitativa dei chetosi (saggio di Selivanov).
È utilizzato in fotografia analogica come rivelatore per la pellicola in bianco e nero.
Note modifica
- ^ scheda del resorcinolo su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) Robert Panico e Jean-Claude Richer, A guide to IUPAC nomenclature of organic compounds: recommendations 1993 : (including revisions, published and hitherto unpublished, to the 1979 edition of Nomenclature of Organic Chemistry), Blackwell Science, 1995, ISBN 9780632034888. URL consultato il 2 febbraio 2018.
- ^ RESORCINA in "Enciclopedia Italiana", su treccani.it. URL consultato il 2 febbraio 2018.
- ^ (J. Meyer, Ber., 1897, 30, p. 2569)
- ^ (EN) M. Nencki e N. Sieber, Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen, in Journal für Praktische Chemie, vol. 23, n. 1, 18 gennaio 1881, pp. 147–156, DOI:10.1002/prac.18810230111. URL consultato il 2 febbraio 2018.
- ^ A. Seyewitz, Bull. Soc. Chins., 1890, 3, p. 811
- ^ (EN) M. C. Traub e C. Hock, Ueber ein Lakmoid, in Berichte der deutschen chemischen Gesellschaft, vol. 17, n. 2, 1º luglio 1884, pp. 2615–2617, DOI:10.1002/cber.188401702192. URL consultato il 2 febbraio 2018.
- ^ JT Hewitt e FG Pope, Jour. C / sterna. Soc., 1897, 75, p. 1084
- ^ (EN) Arthur Michael, Ueber das Verhalten von Natriummalonäther gegen Resorcinol, in Journal für Praktische Chemie, vol. 37, n. 1, 2 giugno 1888, pp. 469–471, DOI:10.1002/prac.18880370144. URL consultato il 2 febbraio 2018.
- ^ Z. Charrouf . e D. Guillaume ., Phenols and Polyphenols from Argania spinosa, in American Journal of Food Technology, vol. 2, n. 7, pp. 679–683, DOI:10.3923/ajft.2007.679.683. URL consultato il 2 febbraio 2018.
- ^ (EN) J. Boer e G. B. E. Jemec, Resorcinol peels as a possible self-treatment of painful nodules in hidradenitis suppurativa, in Clinical and Experimental Dermatology, vol. 35, n. 1, 1º gennaio 2010, pp. 36–40, DOI:10.1111/j.1365-2230.2009.03377.x. URL consultato il 2 febbraio 2018.
Voci correlate modifica
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su resorcinolo
Collegamenti esterni modifica
- (EN) resorcinol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85113163 · GND (DE) 4177862-5 · J9U (EN, HE) 987007534083905171 |
|---|