Triferro dodecacarbonile
Il triferro dodecacarbonile o ferro dodecacarbonile è il composto chimico di formula Fe3(CO)12. Fu uno dei primi cluster metallocarbonile a essere sintetizzato. È una fonte di ferro(0) più reattiva del ferro pentacarbonile. Il composto è disponibile in commercio.
| Triferro dodecacarbonile | |
|---|---|
 | |
| Nome IUPAC | |
| Dodecacarboniltriferro | |
| Nomi alternativi | |
| Ferro dodecacarbonile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Fe3(CO)12 |
| Massa molecolare (u) | 503,66 |
| Aspetto | solido cristallino verde scuro |
| Numero CAS | |
| Numero EINECS | 241-668-5 |
| PubChem | 16212435 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 165 °C (438 K) |
| Temperatura di ebollizione | si decompone |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 11, 21/22, 23, 68/20/21/22 |
| Frasi S | 7, 16, 36/37, 45 |
Proprietà fisiche modifica
Fe3(CO)12 è un solido verde scuro che sublima sotto vuoto, anche se decomponendosi in quantità significativa. È solubile in solventi organici non polari formando soluzioni di colore verde intenso. La maggior parte dei cluster a bassa nuclearità sono invece gialli o arancioni.
Struttura modifica
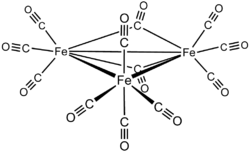
Fe3(CO)12 è un composto molecolare. La sua struttura consiste in un triangolo di atomi di ferro, con attorno 12 leganti CO. Dieci leganti CO sono terminali e due a ponte lungo un legame Fe–Fe; la simmetria della molecola risulta C2v. Per contrasto, Ru3(CO)12 e Os3(CO)12 hanno simmetria D3h, con i 12 leganti CO tutti terminali. Complessivamente, si può considerare che questi tre cluster formalmente nascano dalla condensazione di tre frammenti M(CO)4 a 16 elettroni, come si può pensare che il ciclopropano nasca dalla condensazione di tre unità CH2.
La determinazione della struttura di Fe3(CO)12 è risultata difficile, perché i leganti CO sono disordinati nel cristallo. Una prima evidenza della struttura C2v fu ottenuta da misure di spettroscopia Mössbauer, che rivelò due doppietti di quadrupolo con simili shift isomeri ma diverse costanti di accoppiamento quadrupolare (1,13 e 0,13 mm s–1).
L'anione [HFe3(CO)11]– ha struttura simile a Fe3(CO)12, con un legante idruro che sostituisce un CO a ponte. Il legame all'interno del frammento Fe–H–Fe è descritto come legame a tre centri e due elettroni, usando i concetti sviluppati per il diborano.
Sintesi modifica
Fe3(CO)12 fu ottenuto casualmente dalla decomposizione termica di Fe(CO)5:
- 3Fe(CO)5 → Fe3(CO)12 + 3CO
Anche tracce del composto sono facilmente individuabili per il caratteristico colore verde scuro. La fotolisi di Fe(CO)5 produce Fe2(CO)9 e non Fe3(CO)12.
Una sintesi efficiente di Fe3(CO)12 si ha facendo reagire Fe(CO)5 con una base:[1]
- 3Fe(CO)5 + Et3N + H2O → [Et3NH][HFe3(CO)11] + 3CO + CO2
e quindi ossidando con acido l'idruro ottenuto:
- [Et3NH][HFe3(CO)11] + HCl + CO → Fe3(CO)12 + H2 + [Et3NH]Cl
La sintesi originale di Walter Hieber utilizzava la reazione di H2Fe(CO)4 con MnO2. Al cluster prodotto fu assegnata solo la formula "Fe(CO)4".[2]
Reattività modifica
Fe3(CO)12 è un solido che si decompone lentamente all'aria, e deve essere conservato al freddo in atmosfera inerte.
Per riscaldamento Fe3(CO)12 forma con bassa resa il cluster carburico Fe5(CO)15C. Questa reazione avviene per disproporzione di CO per dare CO2 e carbonio.
Soluzioni molto calde di Fe3(CO)12 si decompongono formando uno specchio di ferro che può essere piroforico in aria.
Come la maggior parte dei metallocarbonili, Fe3(CO)12 dà reazioni di sostituzione; ad esempio con trifenilfosfina forma Fe3(CO)11(PPh3).
Per trattamento con basi si formano anioni carbonilati tipo [HFe3(CO)11]– e [Fe4(CO)13]2–.
Fe3(CO)12 reagisce con 1,3-ditiolopropano per formare il μ-(1,3-ditiolatopropano)-esacarbonildiferro, stabile all'aria, dove i due atomi di zolfo sono a ponte tra i due atomi di ferro. Questo composto è un modello di alcune idrogenasi ferro-ferro.[3]
Sicurezza modifica
Come tutti i metallocarbonili, Fe3(CO)12 è pericoloso in quanto fonte di ferro volatile e monossido di carbonio. Risulta nocivo per contatto con la pelle e per ingestione, e tossico per inalazione. I campioni solidi, specie se finemente suddivisi, e i residui di reazione possono essere piroforici, e possono incendiare i solventi organici in uso. Non si conoscono dati su eventuali proprietà cancerogene.[4]
Note modifica
- ^ W. McFarlane, G. W. Wilkinson, Triiron dodecacarbonyl, in Inorg. Synth., vol. 8, 1966, pp. 181-183, DOI:10.1002/9780470132395.ch47.
- ^ W. Hieber, F. Leutert, Über Metallcarbonyle. XII. Die Basenreaktion des Eisenpentacarbonyls und die Bildung des Eisencarbonylwasserstoffs, in Z. anorg. allg. Chem., vol. 204, n. 1-2, 1932, pp. 145-164, DOI:10.1002/zaac.19322040115.
- ^ C. F. Works, Synthesis, purification, and characterization of a μ-(1,3-propanedithiolato)-hexacarbonyldiiron. Laboratory experiment or mini-project for inorganic chemistry or integrated laboratory, in J. Chem. Educ., vol. 84, n. 5, 2007, p. 836, DOI:10.1021/ed084p836.
- ^ Alfa Aesar, Scheda dei dati di sicurezza di Fe3(CO)12 (PDF), su alfa.com:. URL consultato il 10-5-2011.
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Triferro dodecacarbonile