Pentafluoruro di platino
Il pentafluoruro di platino o fluoruro di platino(V) è il composto binario di formula PtF5. È uno dei pochi composti dove il platino ha stato di ossidazione +5 (altri esempi sono quelli contenenti l'anione PF6− come O2PtF6 e XePtF6).[1]
| Pentafluoruro di platino | |
|---|---|
 | |
| Nome IUPAC | |
| pentafluoruro di platino, fluoruro di platino(V) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | PtF5 |
| Massa molecolare (u) | 290,07 |
| Aspetto | solido rosso |
| Numero CAS | |
| SMILES | F[Pt](F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | 80 °C (353 K)[1] |
| Temperatura di ebollizione | 300 °C (573 K)[1] |
| Indicazioni di sicurezza | |
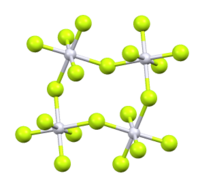
Struttura molecolare
modificaPtF5 ha una struttura tetramerica analoga ai pentafluoruri di rutenio e osmio. Ogni atomo di platino ha coordinazione ottaedrica, con due leganti fluoruro a ponte.[2]
PtF5 cristallizza nel sistema monoclino, gruppo spaziale P21/c, con costanti di reticolo a = 552 pm, c = 1243 pm e β = 99,98°, con 4 unità di formula per cella elementare.[3]
Sintesi
modificaIl composto fu sintetizzato per la prima volta da Neil Bartlett nel 1960.[4] PtF5 si può ottenere tramite fluorurazione controllata ad alta temperatura e sotto pressione:[1]
- 2Pt + 5F2 → 2PtF5
oppure per reazione tra dicloruro di platino e fluoro a 350 °C:[5]
- 2PtCl2 + 5F2 → 2PtF5 + 2Cl2
Reattività
modificaPtF5 è uno degli ossidanti più forti conosciuti. È stato usato per ossidare O2 a O2+[PtF6]− e Xe a XePtF6.[2] Reagisce violentemente in acqua ossidandola a ossigeno:[1]
- 4PtF5 + 10H2O → 4Pt + 20HF + 5O2
Per riscaldamento disproporziona a PtF4 e PtF6:[5]
- 2PtF5 → PtF4 + PtF6
Note
modificaBibliografia
modifica- (EN) N. Bartlett e D. H. Lohmann, Two new fluorides of platinum, in Proceedings of the Chemical Society, 1960, pp. 14-15, DOI:10.1039/PS9600000001.
- (DE) G. Brauer, Handbuch der Präparativen Anorganischen Chemie, 3ª ed., Stuttgart, Enke, 1975, ISBN 3-432-02328-6.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) B. G. Müller e M. Serafin, Single-crystal investigations on PtF4 and PtF5, in European Journal of Solid State Inorganic Chemistry, vol. 29, n. 4-5, 1992, pp. 625-633, DOI:10.1002/chin.199245006.