Tegaserod
Tegaserod è un agonista dei recettori 5-HT4, utilizzato per il trattamento della sindrome dell'intestino irritabile e della costipazione. Il farmaco è prodotto e venduto dalla società farmaceutica Novartis con il nome commerciale di Zelnorm e Zelmac. Approvato dalla Food and Drug Administration (FDA) degli USA nel 2002, è stato successivamente ritirato dal mercato nel 2007, a causa delle preoccupazioni della FDA circa i possibili effetti avversi cardiovascolari. Prima di allora tegaserod era l'unico farmaco approvato dalla FDA per contribuire ad alleviare il disagio addominale, il senso di gonfiore e la costipazione associata alla sindrome del colon irritabile.[1][2] Il suo uso era stato approvato anche per il trattamento della costipazione idiopatica cronica. Attualmente, tegaserod può essere utilizzato solo in situazioni di emergenza e solo previa autorizzazione da parte della FDA.
| Tegaserod | |
|---|---|
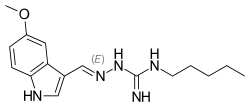 | |
 | |
| Nome IUPAC | |
| (2E)-2-[(5-Methoxy-1H-indol-3-yl)methylene]-N-pentylhydrazinecarboximidamide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C16H23N5O |
| Massa molecolare (u) | 301.39 g/mol |
| Numero CAS | |
| Numero EINECS | 630-469-2 |
| Codice ATC | A06 |
| PubChem | 5362436 CID 5362436 |
| DrugBank | DBDB01079 |
| SMILES | CCCCCNC(=N)NN=CC1=CNC2=C1C=C(OC)C=C2 |
| Dati farmacologici | |
| Modalità di somministrazione | Orale |
| Dati farmacocinetici | |
| Biodisponibilità | 10% |
| Legame proteico | 98% |
| Emivita | 11 ± 5 ore |
| Escrezione | Fecale (67%) e renale (33%) |
| Indicazioni di sicurezza | |
Farmacodinamica
modificaTegaserod agisce legandosi con alta affinità ai recettori 5-HT4 localizzati sui neuroni del tratto gastroenterico.[3] L'attivazione di questi recettori comporta una stimolazione della peristalsi e della capacità secretiva dell'intestino, inibendo nel contempo le sensazioni viscerali. Tegaserod è anche un antagonista del recettore 5-HT2B.[4] La molecola presumibilmente determina un aumento dell'attività motoria basale dell'intestino e normalizza la motilità alterata in tutto il tratto gastrointestinale, riducendo così anche la sensazione di dolore addominale.
Farmacocinetica
modificaA seguito di somministrazione per via orale tegaserod viene assorbito in modo limitato dal tratto gastrointestinale. La concentrazione plasmatica di picco (Cmax) viene raggiunta nel giro di 1 ora (Tmax). La biodisponibilità è solo del 10% circa (in individui a digiuno) e l'assunzione con del cibo ne riduce ulteriormente la biodisponibilità (del 40-65% circa) ritardando anche il Tmax.br> Nell'organismo il composto si distribuisce ampiamente nei fluidi e tessuti biologici. Il legame con le proteine plasmatiche è di circa il 98%. L'emivita è pari a circa 11 ore, con una variabilità individuale tra le 6 e le 16 ore. Non è noto se tegaserod possa oltrepassare la barriera placentare. Studi sperimentali hanno messo in evidenza che la molecola può essere dosata nel latte di ratti, ma non è chiaro se ciò avvenga anche con il latte umano. Dopo una prima idrolisi acida gastrica tegaserod viene ossidato e glucuronidato nel principale metabolita inattivo, l'acido 5-metossiindolo-3-carbossilico glucuronato. Il composto viene eliminato principalmente attraverso le feci (nella misura del 67% circa) come farmaco immodificato e nelle urine (per il restante 33%), come metabolita.[5][6]
Usi clinici
modificaTegaserod trova indicazione nel trattamento della sindrome dell'intestino irritabile (IBS), specialmente nelle donne in cui tra i sintomi predomina la stipsi.[7][8] Viene anche utilizzato nel trattamento della stipsi cronica idiopatica (cioè da causa sconosciuta) nei soggetti anziani, ovvero con un'età superiore ai 65 anni.[9][10]
Effetti collaterali e indesiderati
modificaDurante il trattamento con il farmaco tra gli eventi avversi che si sono verificati con maggiore frequenza si segnalano: cefalea, emicrania, vertigine, dorsalgia (mal di schiena), dolore agli arti inferiori ed in particolare alle gambe, dolore articolare, miopatia. Sono stati segnalati anche disturbi di tipo gastrointestinale quali nausea, vomito, dolore addominale, senso di tensione e ripienezza addominale, flatulenza, diarrea. Possono anche verificarsi altri sintomi come affaticamento, faringite, congestione della mammella, dismenorrea, prurito ed eruzioni cutanee.
L'effetto avverso più grave in corso di terapia con tegaserod è stato riconosciuto nella fase post-marketing e consiste in un incremento del rischio di infarto del miocardio o di ictus cerebrale.
Il 30 marzo 2007, la Food and Drug Administration ha chiesto che la società Novartis provvedesse al ritiro dal commercio di tegaserod.
L'autorità del farmaco statunitense a seguito di dati raccolti nella fase di farmacovigilanza successiva alla commercializzazione sosteneva che esistesse una correlazione tra le prescrizioni del farmaco e l'aumento del rischio di infarto o ictus. L'analisi dei dati raccolti su più di 18.000 pazienti metteva infatti in luce che gravi eventi avversi cardiovascolari (tra questi angina, attacco cardiaco e stroke) si verificavano in 13 pazienti su 11.614 trattati con tegaserod (un tasso del 0,11 %) rispetto a 1 su 7.031 pazienti trattati con placebo (un tasso del 0,01 %).
Novartis ribatteva alla autorità regolatrice sostenendo che tutti i pazienti affetti avevano una preesistente malattia cardiovascolare o fattori di rischio per tale condizione, e che inoltre non vi era nessuna relazione causale tra l'uso di tegaserod ed eventi cardiovascolari.
Lo stesso giorno dell'annuncio della FDA, la Novartis Pharmaceuticals Canada ha annunciato che sospendeva il marketing e le vendite del farmaco in Canada, in risposta ad una richiesta da Health Canada.
Alcune società farmaceutiche in India, come la Cipla e Torrent Pharmaceuticals Ltd., sembrano ch mantengano ancora tegaserod come farmaco generico nei loro listini, e che alcuni venditori online potrebbero ancora venderlo, nonostante il farmaco sia stato bandito in India nel 2011.
Controindicazioni
modificaTegaserod è controindicato in caso di ipersensibilità nota al principio attivo oppure ad uno qualsiasi degli eccipienti contenuti nella formulazione farmacologica. Il farmaco è anche controindicato nei soggetti con insufficienza renale grave, insufficienza epatica moderata o grave, ed in coloro che hanno una storia clinica di ostruzione intestinale, malattie sintomatiche della colecisti, disfunzione dello sfintere di Oddi oppure aderenze addominali.
Note
modifica- ^ LJ. Scott, CM. Perry, Tegaserod., in Drugs, vol. 58, n. 3, Set 1999, pp. 491-6; discussion 497-8, PMID 10493276.
- ^ BE. Lacy, S. Yu, Tegaserod: a new 5-HT4 agonist., in J Clin Gastroenterol, vol. 34, n. 1, Gen 2002, pp. 27-33, PMID 11743242.
- ^ NJ. Talley, Serotoninergic neuroenteric modulators., in Lancet, vol. 358, n. 9298, Dic 2001, pp. 2061-8, DOI:10.1016/S0140-6736(01)07103-3, PMID 11755632.
- ^ DT. Beattie, JA. Smith; D. Marquess; RG. Vickery; SR. Armstrong; T. Pulido-Rios; JL. McCullough; C. Sandlund; C. Richardson; N. Mai; PP. Humphrey, The 5-HT4 receptor agonist, tegaserod, is a potent 5-HT2B receptor antagonist in vitro and in vivo., in Br J Pharmacol, vol. 143, n. 5, Nov 2004, pp. 549-60, DOI:10.1038/sj.bjp.0705929, PMID 15466450.
- ^ M. Camilleri, Review article: tegaserod., in Aliment Pharmacol Ther, vol. 15, n. 3, Mar 2001, pp. 277-89, PMID 11207504.
- ^ S. Appel-Dingemanse, Clinical pharmacokinetics of tegaserod, a serotonin 5-HT(4) receptor partial agonist with promotile activity., in Clin Pharmacokinet, vol. 41, n. 13, 2002, pp. 1021-42, PMID 12403641.
- ^ M. Camilleri, Management of the irritable bowel syndrome., in Gastroenterology, vol. 120, n. 3, Feb 2001, pp. 652-68, PMID 11179242.
- ^ M. Camilleri, Novel medications for the irritable bowel syndrome: motility and sensation., in J Pediatr Gastroenterol Nutr, 32 Suppl 1, 2001, pp. S35-7, PMID 11321419.
- ^ RF. Baun, HB. Levy, Tegaserod for treating chronic constipation in elderly patients., in Ann Pharmacother, vol. 41, n. 2, Feb 2007, pp. 309-13, DOI:10.1345/aph.1H220, PMID 17227825.
- ^ G. Spinzi, A. Amato; G. Imperiali; N. Lenoci; G. Mandelli; S. Paggi; F. Radaelli; N. Terreni; V. Terruzzi, Constipation in the elderly: management strategies., in Drugs Aging, vol. 26, n. 6, 2009, pp. 469-74, DOI:10.2165/00002512-200926060-00003, PMID 19591521.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su tegaserod