Acido carbonico
L'acido carbonico è un ossiacido diprotico poco stabile in cui l'atomo centrale è il carbonio che in questo composto ha come numero di ossidazione +4. Di fatto non esiste allo stato libero, data la sua tendenza a decomporsi spontaneamente in diossido di carbonio e acqua mentre esistono i suoi sali, i carbonati e gli idrogenocarbonati.
| Acido carbonico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acido triossocarbonico(IV) | |
| Caratteristiche generali | |
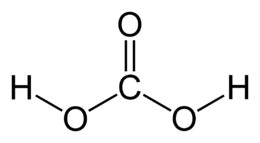
| Formula bruta o molecolare | H2CO3 oppure CO(OH)2 |
| Massa molecolare (u) | 62,03 g/mol |
| Aspetto | Incolore |
| Numero CAS | |
| Numero EINECS | 610-295-3 |
| PubChem | 767 |
| SMILES | C(=O)(O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | Ka1: 4,3×10−7 Ka2: 5,60×10−11 |
| Indicazioni di sicurezza | |
La sua formula chimica ipotetica è H2CO3. Viene reputato il punto d'incontro tra la chimica organica e la chimica inorganica in quanto può essere inteso, in qualche modo, come l'unione di un gruppo ossidrilico (–OH) con un gruppo carbossilico (–COOH). L'acido si forma nell'acqua a partire dal diossido di carbonio per idratazione del gas, ma la velocità di questa reazione è bassa, per cui di fatto l'acido in acqua non esiste in concentrazioni apprezzabili.
Come acido diprotico ha pKa1 = 6,35 ,e pKa2 = 10,3.
Biochimica modifica
Essendo il diossido di carbonio il principale prodotto di scarto della decarbossilazione di amminoacidi e chetoacidi e, in quantità maggiori, del ciclo di Krebs come prodotto ultimo dell'ossidazione del carbonio degli zuccheri, dei grassi e delle proteine a fine energetico, questa viene trasformata in anioni idrogenocarbonato e in minima misura carbonato poiché altrimenti il gas non solubilizzato formerebbe degli emboli gassosi.
La reazione avviene troppo lentamente per essere utile: viene quindi catalizzata dall'anidrasi carbonica, enzima presente nei globuli rossi che a loro volta immagazzinano all'interno l'acido per rilasciarlo dove la pCO2 (pressione parziale del diossido di carbonio) si abbassa. Questo processo prende parte agli scambi gassosi cellulari durante la respirazione e alla regolazione del pH del sangue descritta in seguito.
La stessa reazione avviene nei vasi che circondano la vescica natatoria dei pesci e comporta lo svuotamento e il riempimento della cavità, con conseguente aumento o diminuzione della densità totale e quindi della galleggiabilità.
L'equilibrio multiplo è il seguente:
Questa è una delle reazioni tramite le quali viene mantenuto costante al valore di 7.4 il pH sanguigno. Il potere della soluzione tampone composta da HCO−3 e da CO2 viene esteso dalla possibilità di spostare l'equilibrio più a destra diminuendo, sempre tramite enzima, la concentrazione di diossido di carbonio in soluzione, per poi eliminarla tramite respirazione.
Derivati modifica
Rivestono notevole importanza nel campo della chimica organica i derivati dell'acido carbonico, in particolar modo il dicloruro (fosgene) e la diammide (urea). Notevole rilevanza hanno anche i suoi esteri organici come il dimetilcarbonato e il dietilcarbonato.
Esistono vari suoi analoghi in cui uno o più atomi di ossigeno sono sostituiti da altri calcogeni quali zolfo (acido tritiocarbonico) e selenio (acido triselenocarbonico)
Note modifica
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «acido carbonico»
- Wikimedia Commons contiene immagini o altri file sull'acido carbonico
Collegamenti esterni modifica
- carbonico, acido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) carbonic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 61126 · LCCN (EN) sh89006832 · GND (DE) 4192064-8 · J9U (EN, HE) 987007539190605171 |
|---|
