Acido fulgidico
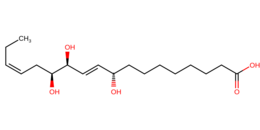
L’acido fulgidico è un acido grasso a catena lineare con 18 atomi di carbonio, due doppi legami in posizione 10=11 e 15=16 e con tre gruppi ossidrilici in posizione 9, 12 e 13. È un epimero C12 dell'acido malingico.
| Acido fulgidico | |
|---|---|
 | |
| Nome IUPAC | |
| acido 9S,12S,13S-tri-OH-18:2-delta-10t,15c | |
| Abbreviazioni | |
| 9S,12S,13S-tri-OH-18:2Δ10t,15c | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C18H32O5 |
| Numero CAS | |
| PubChem | 44559173 |
| SMILES | CCC=CCC(C(C=CC(CCCCCCCC(=O)O)O)O)O |
| Indicazioni di sicurezza | |
Fu isolato per la prima volta nel 1985 da Werner Herz e Palaniappan Kulanthaivel dalla pianta Rudbeckia fulgida.[1][2][3][4] Il nome comune di acido fulgidico deriva dal nome della specie. Inoltre è stato isolato da rizomi della Serrana rodona e Cyperus rotundus[2], utilizzati nella medicina tradizionale cinese per il trattamento di varie malattie e dalle radici di Codonopsis pilosula.[4] È stato dimostrato che ha proprietà anti-infiammatorie.[2]
L'acido fulgidico si trova anche nel riso affetto da brusone, patologia causata dall'ascomicete Magnaporthe grisea[5][6] ed è stato identificato anche come uno ( tipo F ) degli acidi grassi del Corchorus olitorius.[7]
Note
modifica- ^ (EN) Werner Herz e Palaniappan Kulanthaivel, Trihydroxy-C18-acids and a labdane from rudbeckia fulgida, in Phytochemistry, vol. 24, n. 1, 1º gennaio 1985, pp. 89–91, DOI:10.1016/S0031-9422(00)80813-4. URL consultato il 6 febbraio 2020.
- ^ a b c Ji-Sun Shin, Yujin Hong e Hwi-Ho Lee, Fulgidic Acid Isolated from the Rhizomes of Cyperus rotundus Suppresses LPS-Induced iNOS, COX-2, TNF-α, and IL-6 Expression by AP-1 Inactivation in RAW264.7 Macrophages, in Biological and Pharmaceutical Bulletin, vol. 38, n. 7, 2015, pp. 1081–1086, DOI:10.1248/bpb.b15-00186. URL consultato il 6 febbraio 2020.
- ^ (EN) Yusuke Kurashina, Ayako Miura e Masaru Enomoto, Stereoselective synthesis of malyngic acid and fulgidic acid, in Tetrahedron, vol. 67, n. 9, 4 marzo 2011, pp. 1649–1653, DOI:10.1016/j.tet.2011.01.005. URL consultato il 6 febbraio 2020.
- ^ a b (EN) Yueping Jiang, Yufeng Liu e Qinglan Guo, Acetylenes and fatty acids from Codonopsis pilosula, in Acta Pharmaceutica Sinica B, vol. 5, n. 3, 1º maggio 2015, pp. 215–222, DOI:10.1016/j.apsb.2015.03.005. URL consultato il 6 febbraio 2020.
- ^ Hiroshi Suemune, Tetsuji Harabe e Kiyoshi Sakai, Syntheses of Unsaturated Trihydroxy C-18 Fatty Acids Isolated from Rice Plants Suffering from Rice Blast Disease, in Chemical & Pharmaceutical Bulletin, vol. 36, n. 9, 1988, pp. 3632–3637, DOI:10.1248/cpb.36.3632. URL consultato il 6 febbraio 2020.
- ^ (EN) Tadahiro Kato, Yoshihiro Yamaguchi e Nobunori Abe, Structure and synthesis of unsaturaded trihydroxy c18 fatty: Acids in rice plants suffering from rice blast disease, in Tetrahedron Letters, vol. 26, n. 19, 1º gennaio 1985, pp. 2357–2360, DOI:10.1016/S0040-4039(00)95098-6. URL consultato il 6 febbraio 2020.
- ^ (EN) Masayuki Yoshikawa, Toshiyuki Murakami e Hiromi Shimada, Medicinal Foodstuffs. XIV. On the Bioactive Constituents of Moroheiya. (2): New Fatty Acids, Corchorifatty Acids A, B, C, D, E, and F, from the Leaves of Corchorus olitorius L. (Tiliaceae): Structures and Inhibitory Effect on NO Production in Mouse Peritoneal Macrophages., in CHEMICAL & PHARMACEUTICAL BULLETIN, vol. 46, n. 6, 1998, pp. 1008–1014, DOI:10.1248/cpb.46.1008. URL consultato il 6 febbraio 2020.