Idrossido di cobalto(II)
L'idrossido di cobalto(II) è il composto inorganico con formula Co(OH)2, dove il cobalto è nello stato di ossidazione +2. In condizioni normali questo idrossido è di colore rosa, ma si conosce anche una forma blu instabile. La variazione di colore è presumibilmente dovuta a una variazione dell'intorno di coordinazione dello ione cobalto(II).[3]
| Idrossido di cobalto(II) | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Co(OH)2 |
| Massa molecolare (u) | 92,948 |
| Aspetto | polvere rosa o blu |
| Numero CAS | |
| Numero EINECS | 244-166-4 |
| PubChem | 10129900 |
| SMILES | O.O.[Co] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,597 forma rosa[1] |
| Solubilità in acqua | 0,005 g/l a 22,7 ºC[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -539,7[2] |
| ΔfG0 (kJ·mol−1) | -454,3[2] |
| S0m(J·K−1mol−1) | 79,0[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1060 ratto orale[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 302+332 - 317 - 319 - 334 - 351 - 410 [1] |
| Consigli P | 261 - 273 - 280 - 284 - 304+340+312 - 342+311 [1] |
Sintesi
modificaCo(OH)2 precipita aggiungendo un idrossido alcalino ad una soluzione acquosa contenente un sale di Co(II). Ad esempio si può usare il nitrato di cobalto:
Inizialmente si forma un precipitato blu che diventa rapidamente rosa.[4][5]
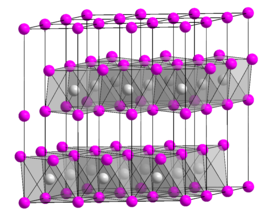
Struttura
modificaL'idrossido di cobalto(II) cristallizza con la struttura esagonale tipo CdI2, analogamente ad altri idrossidi di formula M(OH)2 come quelli di Mg, Ca, Mn, Fe, Ni e Cd. I cationi cobalto sono coordinati ottaedricamente.[6]
Proprietà
modificaL'idrossido di cobalto(II) è facilmente ossidabile e va conservato in atmosfera inerte. Scaldato sotto vuoto si decompone a CoO + H2O. A contatto con l'aria si ossida lentamente a Co2O3 idrato, di colore bruno.[6] La decomposizione termica all'aria sopra 300 ºC produce Co3O4.[7]
Co(OH)2 è praticamente insolubile in acqua. In soluzione acida si scioglie formando la specie [Co(H2O)6]2+. L'idrossido di cobalto(II) è un idrossido anfotero e si scioglie in soluzioni alcaline concentrate formando gli ioni cobaltato [Co(OH)4]2– e [Co(OH)6]4– di colore blu scuro.[6]
Applicazioni
modificaL'idrossido di cobalto(II) è comunemente usato come materiale di partenza per sintetizzare altri composti di cobalto. Viene impiegato industrialmente come catalizzatore e in vernici e inchiostri per tipografia.[7][8]
Tossicità / Indicazioni di sicurezza
modificaIl composto è disponibile in commercio. Risulta nocivo se ingerito o inalato e provoca gravi irritazioni agli occhi. È un sospetto cancerogeno, ed è molto tossico per gli organismi acquatici con effetti di lunga durata.[1]
Note
modificaBibliografia
modifica- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 2, 2ª ed., New York, Academic Press, 1965.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) H. W. Richardson, Cobalt compounds, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- (DE) E. Riedel e C. Janiak, Cobalt(II)-hydroxid, in Anorganische Chemie, Walter de Gruyter, 2011, ISBN 9783110225662.
- Sigma-Aldrich, Cobalt(II) hydroxide, su sigmaaldrich.com, 2015.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Idrossido di cobalto(II)