Dimetilzinco
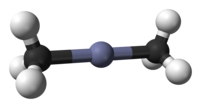
Il dimetilzinco o zincodimetile è il composto organometallico con formula Zn(CH3)2. In condizioni normali è un liquido incolore, piroforico, di odore sgradevole. È solubile in alcani ed è disponibile in commercio come soluzione in questi solventi. È stato un importante reattivo di organo-zinco, utilizzato per la sintesi di composti organici.
| Dimetilzinco | |
|---|---|
 | |
| Nome IUPAC | |
| dimetilzinco | |
| Nomi alternativi | |
| zincodimetile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H6Zn |
| Massa molecolare (u) | 95,478 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 208-884-1 |
| PubChem | 11010 |
| SMILES | C[Zn]C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,386[1] |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | –40 °C (231 K)[1] |
| Temperatura di ebollizione | 46 °C (319 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 250-260-252-314-410 |
| Consigli P | 210-303+361+353-305+351+338-405-422-501[1] |
Storia
modificaIl composto fu preparato per la prima volta nel 1849 da Edward Frankland mentre lavorava con Robert Bunsen all'Università di Marburgo. Dopo aver scaldato una miscela di zinco e iodometano in un recipiente ermetico, all'apertura del recipiente si sprigionò una fiammata.[2] La sintesi a livello di laboratorio utilizza ancora lo stesso metodo, con l'unica differenza che si utilizzano composti di rame per attivare lo zinco.
Struttura
modificaAllo stato solido il composto esiste in due modificazioni. Ad alta temperatura esiste una fase monoclinica con un disordine bidimensionale. A bassa temperatura esiste una fase, pure monoclinica, ma ordinata. La molecola è lineare, con legami Zn–C di 192,7(6) pm.[3] In fase gassosa si osserva una distanza Zn–C molto simile, 193,0(2) pm.[4]
Sintesi
modificaIl composto Zn(CH3)2 si prepara facendo reagire zinco e iodometano in atmosfera inerte a temperatura elevata.
- 2Zn + 2CH3I → Zn(CH3)2 + ZnI2
Reattività
modificaIl dimetilzinco è un composto stabile a temperatura ambiente, ma è piroforico, cioè si infiamma spontaneamente all'aria, formando ZnO. Il composto va sempre maneggiato in atmosfera inerte, dato che reagisce violentemente in presenza di ossigeno o umidità.[5]
Usi
modificaIl dimetilzinco è stato usato per molto tempo per introdurre gruppi metile in molecole organiche o per sintetizzare composti organometallici contenenti gruppi metile. Nella maggior parte delle sintesi di laboratorio si preferisce usare i reattivi di Grignard (composti organo-magnesio) perché sono più semplici da maneggiare e meno infiammabili. Tuttavia esistono delle differenze di reattività e di specificità tra i reattivi di Grignard e i composti organo-zinco, per cui questi ultimi sono preferiti in alcune sintesi.[6]
Il dimetilzinco ha una pressione di vapore elevata ed è per questo usato ampiamente nella deposizione chimica da vapore metallorganica (MOCVD = metalorganic chemical vapor deposition) per preparare film semiconduttori con ampio band gap (ad es. ZnO, ZnS, ZnSe, ZnTe), e come drogante p di semiconduttori III-V (ad es. GaAs, InP, AlxGa1-xAs). Questi materiali hanno applicazioni nei campi dell'elettronica e della fotonica.[7]
Tossicità / Indicazioni di sicurezza
modificaIl dimetilzinco è disponibile in commercio, in genere come soluzione in solventi inerti come toluene o eptano. Per contatto provoca gravi ustioni cutanee e gravi lesioni oculari. Può essere letale per ingestione o inalazione. Non ci sono notizie su eventuali effetti cancerogeni. È molto tossico anche per gli organismi acquatici.[8]
Note
modificaBibliografia
modifica- M. Afzaal, M. A. Malik e P. O’Brien, Preparation of zinc containing materials, in New J. Chem., vol. 31, 2007, pp. 2029–2040, DOI:10.1039/b712235g. URL consultato l'11 febbraio 2014.
- J. Bacsa, F. Hanke, S. Hindley, R. Odedra, G. R. Darling, A. C. Jones e A. Steiner, The Solid State Structures of Dimethylzinc and Diethylzinc, in Angew. Chem. Int. Ed., vol. 50, n. 49, 2011, pp. 11685–11687, DOI:10.1002/anie.201105099. URL consultato l'11 febbraio 2014.
- (EN) E. Erdik, Organozinc reagents in organic synthesis, Boca Raton, CRC Press, 1996, ISBN 0-8493-9151-2.
- E. Frankland, Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten, in Liebigs Ann. Chem., vol. 71, n. 2, 1849, pp. 213-216, DOI:10.1002/jlac.18490710206. URL consultato l'11 febbraio 2014.
- GESTIS, Dimethyl zinc, su Pagina del dimetilzinco nel data base GESTIS. URL consultato l'11 febbraio 2014 (archiviato dall'url originale il 22 febbraio 2014).
- (EN) J.-M. Grévy, Zinc: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia261, ISBN 978-0-470-86210-0.
- A. Haaland, J. C. Green, G. S. McGrady, A. J. Downs, E. Gullo, M. J. Lyall, J. Timberlake, A. V. Tutukin, H. V. Volden e K.-A. Østby, The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy, in Dalton Trans., 2003, pp. 4356–4366, DOI:10.1039/B306840B. URL consultato l'11 febbraio 2014.
- Sigma-Aldrich, Scheda di dati di sicurezza di dimetilzinco soluzione.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Dimetilzinco
| Controllo di autorità | GND (DE) 4346795-7 |
|---|