Ormoni tiroidei
Gli ormoni tiroidei sono due ormoni prodotti dai tireociti della tiroide: la tetra-iodotironina o tiroxina (T4), e la tri-iodotironina (T3).

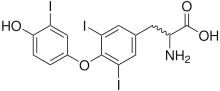

Questi ormoni sono a base di tirosina, e contengono rispettivamente 4 e 3 atomi di iodio. La loro funzione è quella di regolare il metabolismo.
Descrizione modifica
La tiroide produce T4 in concentrazioni significativamente maggiori rispetto alla forma T3, che possiede anche un'emivita minore.[1] La forma T3 è molto più attiva e può essere ottenuta, a seconda delle necessità dell'organismo, dall'ormone T4 grazie all'enzima deiodasi presente nei tessuti. Tutte e tre le isoforme dell'enzima deiodasi contengono selenio, che viene assunto tramite la dieta ed è essenziale per la produzione di T3.
La quantità di ormoni tiroidei presenti nel plasma si misura con metodo radioimmunologico o tramite chemiluminescenza: si ha ipertiroidismo se tale quantità è superiore alla norma, ipotiroidismo se è inferiore. La tiroxina è sintetizzabile, e la preparazione farmaceutica è impiegata nella terapia dell'ipotiroidismo e del gozzo semplice. Il gozzo è l'ingrandimento della ghiandola tiroidea, che è causata dalla mancata conversione dello iodio nella forma ionizzata, questo fa sì che la tiroxina non venga legata nonostante le stimolazioni del s.n.c. La secrezione degli ormoni tiroidei è controllata dall'ipotalamo, il quale rilascerà un neurotrasmettitore tripeptidico, il TRH, il quale stimolerà le cellule tireotrope dell'ipofisi anteriore (o adenoipofisi) a rilasciare ormone tireostimolante TSH. Gli ormoni tiroidei circolano legati a proteine di trasporto in misura >99%.
Produzione modifica
Centrale modifica
Gli ormoni tiroidei (T4 e T3) sono prodotti dalle cellule follicolari della ghiandola tiroidea e sono regolati dal TSH prodotto dalle cellule tireotrope dell'adenoipofisi . T3 molto più attivo attivo di T4[2] e infatti T4 è considerata come una forma inattiva di ormone tiroideo .
La tiroxina (3,5,3 ', 5'-tetraiodotironina) è prodotta dalle cellule follicolari della tiroide. È prodotto come il precursore della tireoglobulina (non è la stessa della globulina legante la tiroxina (TBG)), che viene scisso dagli enzimi per produrre T4 attivo.[2]
I passaggi in questo processo sono i seguenti:[3]
- Il trasportatore Na + / I- trasporta due ioni di sodio attraverso la membrana basale delle cellule follicolari insieme a uno ione ioduro. Questo è un trasportatore attivo secondario che utilizza il gradiente di concentrazione di Na + per spostare I- contro il suo gradiente di concentrazione.
- I- attraverso la membrana apicale , penetra nel colloide del follicolo.
- La tireoperossidasi ossida due I-in forma I2. Lo ioduro non è reattivo e per lo step successivo è richiesto solo lo iodio reattivo.
- La perossidasi tiroidea aggiunge i residui tirosilici della tireoglobulina all'interno del colloide. La tireoglobulina è stata sintetizzata nel reticolo endoplasmatico della cellula follicolare e secreta nel colloide.
- La tireoglobulina iodata lega la megalina per l'endocitosi nella cellula.
- L'ormone stimolante la tiroide (TSH) rilasciato dall'ipofisi anteriore (noto anche come adenoipofisi) lega il recettore del TSH (un recettore accoppiato alla proteina Gs) sulla membrana basolaterale della cellula e stimola l'endocitosi del colloide.
- Le vescicole endocitate si fondono con i lisosomi della cellula follicolare. Gli enzimi lisosomali scindono il T4 dalla tireoglobulina iodinata.
- Gli ormoni tiroidei attraversano la membrana delle cellule follicolari verso i vasi sanguigni attraverso un meccanismo sconosciuto[4]. I libri di testo affermano che la diffusione è il principale mezzo di trasporto,ma studi recenti indicano che il trasportatore monocarbossilico (MCT) 8 e 10 gioca un ruolo importante nell'efflusso degli ormoni tiroidei dalle cellule tiroidee[5][6]
La tireoglobulina (Tg) è una proteina dimerica di 6,6 kDa prodotta dalle cellule follicolari della tiroide e utilizzata interamente nella ghiandola tiroidea[2]. La tiroxina viene prodotta collegando gli atomi di iodio alle strutture ad anello dei residui di tirosina di questa proteina; la tiroxina (T4) contiene quattro atomi di iodio, mentre la triiodotironina (T3), altrimenti identica a T4, ha un atomo di iodio in meno per molecola. La proteina della tireoglobulina rappresenta circa la metà del contenuto proteico della ghiandola tiroidea.[3] . Ciascuna molecola di tireoglobulina contiene circa 100-120 residui di tirosina, un piccolo numero dei quali (<20) sono soggetti a iodurazione catalizzata dalla tireoperossidasi.[7] Lo stesso enzima catalizza quindi "l'accoppiamento" di una tirosina modificata con un'altra, attraverso una reazione mediata dai radicali liberi, e quando queste molecole iodurate vengono rilasciate dall'idrolisi della proteina, T3 e T4 sono il risultato. Pertanto, ciascuna molecola di proteina tireoglobulina alla fine produce quantità molto piccole di ormone tiroideo (osservate sperimentalmente nell'ordine di 5-6 molecole di T4 o T3 per molecola originale di tireoglobulina).[2]
Più specificamente, la forma anionica di iodio, ioduro, I-, viene attivamente assorbita dal flusso sanguigno mediante un processo chiamato intrappolamento dello ioduro.[8] In questo processo, il sodio viene cotrasportato con ioduro dal lato basolaterale della membrana nella cellula, e poi concentrato nei follicoli tiroidei a circa trenta volte la sua concentrazione nel sangue.[8] Quindi, nella prima reazione catalizzata dall'enzima tireoperossidasi, i residui di tirosina nella proteina tireoglobulina sono iodati sui loro anelli fenolici, in una o entrambe le posizioni orto al gruppo idrossilico fenolico, producendo monoiodotirosina (MIT) e diiodotirosina (DIT), rispettivamente. Questo introduce 1-2 atomi dell'elemento di iodio, legato in modo covalente, per residuo di tirosina. L'ulteriore accoppiamento di due residui di tirosina completamente iodati, anch'essi catalizzati dalla tireoperossidasi, fornisce il precursore peptidico (ancora legato al peptide) della tiroxina e l'accoppiamento di una molecola del MIT e una molecola di DIT rende il precursore paragonabile della triiodotironina:
- MIT peptidico + DIT peptidico → triiodotironina peptidica (eventualmente rilasciata come triiodotironina, T3)
- 2 DIT peptidiche → tiroxina peptidica (eventualmente rilasciata come tiroxina, T4)
L'idrolisi (scissione dei singoli amminoacidi) della proteina modificata dalle proteasi libera quindi T3 e T4, così come i derivati di tirosina non accoppiati MIT e DIT. Gli ormoni T4 e T3 sono gli agenti biologicamente attivi fondamentali per la regolazione metabolica.
Periferici modifica
Si ritiene che la tiroxina sia un pro-ormone e un precursore per l'ormone tiroideo T3 (la forma più attiva e principale)[9] T4 viene convertito come richiesto nei tessuti dalla iodotironina deiodinasi.[10] Il deficit della deiodinasi può creare un quadro di ipotiroidismo a causa della carenza di iodio.[11] T3 è più attivo di T4, sebbene sia presente in meno quantità di T4.[12]
Funzioni modifica
Gli ormoni tiroidei agiscono su quasi tutte le cellule dell'organismo. In condizioni fisiologiche gli ormoni tiroidei stimolano i processi anabolici, vale a dire di crescita, sviluppo e movimento dell'organismo. In particolare la loro funzione è quella di aumentare il metabolismo basale, influenzare la sintesi proteica, aiutare a regolare la crescita delle ossa lunghe (in sinergia con l'ormone della crescita), la maturazione neuronale, e aumentare la sensibilità del corpo alle catecolamine (come l'adrenalina).
Gli ormoni tiroidei sono essenziali per il corretto sviluppo e la corretta differenziazione di tutte le cellule del corpo umano. Essi agiscono aumentando: la funzione renale, la gittata cardiaca e la ventilazione respiratoria, la mobilizzazione di lipidi, carboidrati e proteine ed infine sulla termoregolazione. In generale gli ormoni tiroidei favoriscono la generazione di calore corporeo negli esseri umani. Tuttavia, alcuni di essi possono inibire l'attività neuronale, producendo un calo della temperatura corporea, fatto che gioca un ruolo importante nei cicli di ibernazione dei mammiferi e nella muta degli uccelli.
Gli ormoni tiroidei hanno anche la funzione di regolare il metabolismo delle proteine, dei grassi, dei carboidrati e delle vitamine. Inoltre, aumentano il processo di ossidazione delle cellule controllando gli enzimi che presiedono al metabolismo energetico (interferiscono con la fosforilazione ossidativa impedendo ad AMP ed ADP di essere convertiti in ATP; l'energia sottratta a tale reazione viene emessa sotto forma di calore, da cui i sintomi di eccessivo calore o freddo tipici rispettivamente di iper e ipo tiroidismo).
Infine gli ormoni tiroidei hanno la funzione di promuovere lo sviluppo dell'encefalo nel feto, infatti, in presenza di una scarsa produzione ormonale, i neonati possono andare incontro a un forte ritardo mentale (cretinismo infantile).
La sintesi degli ormoni tiroidei viene a sua volta influenzata da numerosi stimoli fisiologici e patologici. In dosi elevate, come nel caso di malattie della tiroide, inducono un aumento dei processi catabolici, cioè di distruzione, consumo ed eccessiva attività metabolica, con perdita energetica da parte dell'organismo.
Meccanismo d'azione modifica
Gli ormoni tiroidei funzionano attraverso dei recettori nucleari, detti recettori degli ormoni tiroidei. Questi recettori insieme ai corepressori legano sequenza di DNA specifiche denominate elementi di risposta dell'ormone tiroideo. Il complesso recettore-corepressore-DNA può bloccare la trascrizione genica. Quando la triiodotironina (T3) si lega al recettore, induce un cambiamento conformazionale, che causa il distacco del corepressore dal complesso. Questo porta al reclutamento dell'RNA polimerasi, che procede alla trascrizione del gene.[13] Sebbene questo modello funzionale abbia un notevole sostegno sperimentale, rimangono molti quesiti irrisolti.[14]
Note modifica
- ^ Irizarry Lisandro, Thyroid Hormone Toxicity: Background, Pathophysiology, Epidemiology, in Medscape, 23 aprile 2014. URL consultato il 27 aprile 2018.
- ^ a b c d Chapter 2 Thyroid Hormone Synthesis And Secretion Bernard Rousset, Corinne Dupuy, Françoise Miot, Ph.D., and Jacques Dumont, M.D..
- ^ a b Chapter 49, "Synthesis of Thyroid Hormones" in: Walter F. Boron; Emile L. Boulpaep (2012). Medical Physiology (2nd ed.). Elsevier/Saunders..
- ^ Human Anatomy & Physiology, Sixth Edition. Benjamin Cummings. May 2, 2003.
- ^ Friesema, Edith C. H.; Jansen, Jurgen; Jachtenberg, Jan-willem; Visser, W. Edward; Kester, Monique H. A.; Visser, Theo J. (2008). "Effective Cellular Uptake and Efflux of Thyroid Hormone by Human Monocarboxylate Transporter 10". Molecular Endocrinology. 22 (6): 1357–1369.
- ^ Brix, Klaudia; Führer, Dagmar; Biebermann, Heike (2011). "Molecules important for thyroid hormone synthesis and action - known facts and future perspectives". Thyroid Research. 4 (Suppl 1): S9.
- ^ Boron, W.F. (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders.
- ^ a b Resveratrol increases iodide trapping in the rat thyroid cell line FRTL-5. Sebai H1, Hovsépian S, Ristorcelli E, Aouani E, Lombardo D, Fayet G..
- ^ Kansagra, Shayri M.; McCudden, Christopher R.; Willis, Monte S. (June 2010). "The Challenges and Complexities of Thyroid Hormone Replacement". Laboratory Medicine. 41 (6): 338–348.
- ^ St. Germain, Donald L.; Galton, Valerie Anne; Hernandez, Arturo (March 2009). "Defining the Roles of the Iodothyronine Deiodinases: Current Concepts and Challenges". Endocrinology. 150 (3): 1097–1107.
- ^ Wass, John A.H.; Stewart, Paul M., eds. (2011). Oxford Textbook of Endocrinology and Diabetes (2nd ed.). Oxford: Oxford University Press. p. 565.
- ^ Wass, John A.H.; Stewart, Paul M., eds. (2011). Oxford Textbook of Endocrinology and diabetes (2nd ed.). Oxford: Oxford University Press. p. 18.
- ^ Y. Wu e R. J. Koenig, Gene regulation by thyroid hormone, in Trends in endocrinology and metabolism: TEM, vol. 11, n. 6, August 2000, pp. 207–211, PMID 10878749. URL consultato il 27 aprile 2018.
- ^ Stephen Ayers, Michal Piotr Switnicki e Anusha Angajala, Genome-wide binding patterns of thyroid hormone receptor beta, in PloS One, vol. 9, n. 2, 2014, pp. e81186, DOI:10.1371/journal.pone.0081186, PMID 24558356. URL consultato il 27 aprile 2018.
Voci correlate modifica
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su ormoni tiroidei
Collegamenti esterni modifica
- (EN) thyroid hormone, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 23579 · LCCN (EN) sh85135174 · BNF (FR) cb12157780r (data) · J9U (EN, HE) 987007536575605171 |
|---|