Cubano
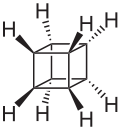
Il cubano è un idrocarburo pentaciclico alifatico avente formula C8H8 o (CH)8.[1] Deve il suo nome al fatto che gli 8 atomi dello scheletro di carbonio sono disposti ai vertici di un cubo. In quanto tale, fa parte degli idrocarburi platonici,[2][3] insieme al tetraedrano (finora non noto, ma se ne conoscono alcuni derivati) e al dodecaedrano. È il più semplice idrocarburo con simmetria ottaedrica, gruppo puntuale Oh.[4]
| Cubano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Pentaciclo[4.2.0.02,5.03,8.04,7]ottano | |
| Nomi alternativi | |
| [4]Prismano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H8 |
| Massa molecolare (u) | 104,15 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| PubChem | 136090 |
| SMILES | C12C3C4C1C5C2C3C45 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,29 |
| Temperatura di fusione | 133,5 °C (406,7 K) |
| Temperatura di ebollizione | 161,5 °C (a 200 °C si decompone) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 144 kcal/mol (602 kJ/mol) |
| Indicazioni di sicurezza | |
Prima della sua sintesi, realizzata ad opera di P. Eaton e T. Cole nel 1964,[5] Eaton credette che il cubano non avrebbe potuto essere ottenuto a causa della necessaria presenza di angoli di legame di 90° che avrebbero comportato grande tensione angolare nella molecola.[6]
Il cubano rappresenta anche un caso particolare degli [n]prismani, il [4]prismano, omologo superiore del [3]prismano (ossia, il benzene di Ladenburg).[7][8]
Struttura
modificaNello scheletro della molecola del cubano (come pure in quelli dei suoi derivati) 3 dei 4 angoli di legame di ogni atomo di carbonio sono necessariamente di 90°, valore molto distante da quello dell'angolo tetraedrico (109,5°), che è quello naturale per l'ibridazione sp3. Inoltre, ognuno degli 8 idrogeni, situati sui prolungamenti delle diagonali del cubo, è eclissato. La tensione d'anello che ne risulta, somma delle tensioni angolare e torsionale (o di eclissamento), è di entità veramente notevole: è stata valutata in 154,7 kcal/mol (19,3 kcal/mol per ogni unità CH); quella del ciclobutano, per confronto, ammonta a 26,5 kcal/mol (6,62 kcal/mol per ogni unità CH2, cioè solo un terzo, circa), mentre quella del tetraedrano è stimata in 140 kcal/mol (35 kcal/mol per ogni unità CH).[9]
Tramite indagini di diffrazione elettronica[10] in fase gassosa si è visto che i legami C−C sono lunghi 157,27 ± 0,19 pm, più del valore normale di 154 pm,[11] ma maggiore anche di quelli nel ciclobutano (155,1 pm); anche i legami C−H (111,8 ± 0,8 pm) sono più lunghi rispetto a quelli del ciclobutano (109 pm).[12][13][14]
Proprietà
modificaA temperatura e pressione ambiente il cubano è un solido cristallino polimorfico,[15] incolore, ed eccezionalmente denso, per essere un idrocarburo (1,29 g/cm³);[16] è solubile in esano ed altri solventi idrocarburici.[17] Il solido fonde a 133,5 °C e bolle a 161,6 °C.[18] L'alta densità implica anche alta densità di energia sviluppata nella sua combustione rispetto ad altri idrocarburi.[19]
Con la sua tensione d'anello, non sorprende che il cubano sia un idrocarburo fortemente endotermico, ΔHƒ° = +542 ± 3 kJ/mol,[20] quindi termodinamicamente molto instabile, anche se mostra una notevole stabilità cinetica. Infatti, nonostante la molecola sia così fortemente in tensione, il cubano appare insolitamente stabile termicamente: si decompone solo a partire da circa 200 °C, ben oltre la temperatura di ebollizione, dando principalmente l'isomero cicloottatetraene.
Questo è dovuto al fatto che anche l'energia di attivazione per l'isomerizzazione è relativamente alta, 180,5 kJ/mol.[21][22] Il cubano risulta relativamente stabile anche alla luce, all'aria e all'acqua,[23] per cui è maneggiabile in laboratorio chimico sotto cappa aspirante senza ulteriori particolari limitazioni, tranne ovviamente quelle relative alla sicurezza.
Trattato con catalizzatori a base di Ag(I) o Pd(II) si isomerizza a cuneano.[24][25] Con catalizzatore a base di Rh(I) si trasforma inizialmente in sin-tricicloottadiene[26][27] il quale, se scaldato a 50 - 60 °C, si converte poi a ciclottatetraene.[28]
A causa del surplus di energia nella molecola, il cubano e suoi derivati trovano occasionalmente applicazioni come additivi per carburanti o esplosivi ad elevata densità[19] (per il cubano il calore di combustione ammonta a ben 4.833,27 kJ/mol[20]). Uno degli esplosivi di ultima generazione è l'ottanitrocubano[29] ed ha una velocità di esplosione di circa 10.000 m/s.[30]
In connessione alla stabilità della sua struttura a temperatura ambiente e della relativa bassa tossicità, alcuni suoi derivati sono anche oggetto di ricerca in medicina,[31] per applicazioni ottiche[32] e nelle nanotecnologie.[33][34]
Sintesi
modificaIl cubano è un idrocarburo sintetico, la sua molecola è stata sintetizzata nel 1964 da Philip E. Eaton e Thomas W. Cole dell'Università di Chicago.[5] La sintesi include l'utilizzo di due riarrangiamenti di Favorskii. Fino ad allora si era pensato che l'esistenza di molecole del genere potesse essere solo teorica e che la loro sintesi fosse impossibile per via dell'instabilità indotta dal forzare atomi di carbonio sp3 (vedi: cicloalcani) a formare legami ad angolo retto. Una possibile sintesi del cubano è illustrata nello schema seguente:[35]
Note
modifica- ^ (EN) Kyle F. Biegasiewicz, Justin R. Griffiths e G. Paul Savage, Cubane: 50 Years Later, in Chemical Reviews, vol. 115, n. 14, 22 luglio 2015, pp. 6719–6745, DOI:10.1021/cr500523x. URL consultato il 15 maggio 2022.
- ^ Hopf 2000
- ^ Law 2017, p. 1630.
- ^ CCCBDB listing of experimental geometry data page 2, su cccbdb.nist.gov. URL consultato il 24 gennaio 2023.
- ^ a b (EN) Philip E. Eaton e Thomas W. Cole, Cubane, in Journal of the American Chemical Society, vol. 86, n. 15, 1964-08, pp. 3157–3158, DOI:10.1021/ja01069a041. URL consultato il 24 gennaio 2023.
- ^ John W. Moore, Conrad L. Stanitski e Peter C. Jurs, Chemistry: the molecular science, Harcourt College Publishers, 2002, ISBN 978-0-03-032011-8.
- ^ (EN) Harry P. Schultz, Topological Organic Chemistry. Polyhedranes and Prismanes, in The Journal of Organic Chemistry, vol. 30, n. 5, 1965-05, pp. 1361–1364, DOI:10.1021/jo01016a005. URL consultato il 18 aprile 2022 (archiviato il 12 gennaio 2021).
- ^ Raimondo Germani, Molecole dalla forma curiosa (PDF), 2018. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ F. A. Carey e R. J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms, Fifth Edition, Springer Science+Business Media, LLC, 2007, p. 88, ISBN 978-0-387-68346-1.
- ^ diffrazione di elettroni in "Enciclopedia della Scienza e della Tecnica", su treccani.it. URL consultato il 23 aprile 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ (EN) Lise Hedberg, Kenneth Hedberg e Philip E. Eaton, Bond lengths and quadratic force field for cubane, in Journal of the American Chemical Society, vol. 113, n. 5, 1991-02, pp. 1514–1517, DOI:10.1021/ja00005a007. URL consultato il 18 aprile 2022.
- ^ (EN) Norman L. Allinger e Philip E. Eaton, The geometries of pentaprismane and hexaprismane insights from molecular mechanics, in Tetrahedron Letters, vol. 24, n. 35, 1º gennaio 1983, pp. 3697–3700, DOI:10.1016/S0040-4039(00)94512-X. URL consultato il 18 aprile 2022.
- ^ (EN) Norman L. Allinger, Conformational analysis. 130. MM2. A hydrocarbon force field utilizing V1 and V2 torsional terms, in Journal of the American Chemical Society, vol. 99, n. 25, 1977-12, pp. 8127–8134, DOI:10.1021/ja00467a001. URL consultato il 18 aprile 2022 (archiviato il 9 aprile 2022).
- ^ (EN) Mary Anne White, Roderick E. Wasylishen e Philip E. Eaton, Orientational disorder in solid cubane: a thermodynamic and carbon-13 NMR study, in The Journal of Physical Chemistry, vol. 96, n. 1, 1992-01, pp. 421–425, DOI:10.1021/j100180a078. URL consultato il 18 aprile 2022 (archiviato l'11 dicembre 2020).
- ^ (EN) Philip E. Eaton, Cubanes: Starting Materials for the Chemistry of the 1990s and the New Century, in Angewandte Chemie International Edition in English, vol. 31, n. 11, 1992-11, pp. 1421–1436, DOI:10.1002/anie.199214211. URL consultato il 24 gennaio 2023.
- ^ Start, su ch.ic.ac.uk. URL consultato il 24 gennaio 2023.
- ^ (EN) Kyle F. Biegasiewicz, Justin R. Griffiths e G. Paul Savage, Cubane: 50 Years Later, in Chemical Reviews, vol. 115, n. 14, 22 luglio 2015, pp. 6719–6745, DOI:10.1021/cr500523x. URL consultato il 18 aprile 2022 (archiviato il 28 novembre 2021).
- ^ a b High energy derivatives of Cubane, su archive.wikiwix.com. URL consultato il 24 gennaio 2023.
- ^ a b B. D. Kybett, S. Carroll e P. Natalis, Thermodynamic properties of cubane, vol. 88, 1966, pp. 626. URL consultato il 7 agosto 2023.
- ^ (EN) Hans-Dieter Martin, Thomas Urbanek e Peter Pföhler, The pyrolysis of cubane; an example of a thermally induced hot molecule reaction, in J. Chem. Soc., Chem. Commun., n. 14, 1985, pp. 964–965, DOI:10.1039/C39850000964. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ (EN) Ahmad Seif, Luis R. Domingo e Ehsan Zahedi, Unraveling the kinetics and molecular mechanism of gas phase pyrolysis of cubane to [8]annulene, in RSC Advances, vol. 10, n. 54, 2020, pp. 32730–32739, DOI:10.1039/D0RA05371F. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ (DE) Philip E. Eaton, Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts, in Angewandte Chemie, vol. 104, n. 11, 1992-11, pp. 1447–1462, DOI:10.1002/ange.19921041105. URL consultato il 18 aprile 2022 (archiviato il 19 febbraio 2022).
- ^ Nome sistematico: Pentaciclo[3.3.0.02,4.03,7.06,8]ottano
- ^ (EN) Philip E. Eaton, Luigi Cassar e Jack Halpern, Silver(I)- and palladium(II)-catalyzed isomerizations of cubane. Synthesis and characterization of cuneane, in Journal of the American Chemical Society, vol. 92, n. 21, 1970-10, pp. 6366–6368, DOI:10.1021/ja00724a061. URL consultato il 18 aprile 2022 (archiviato il 29 ottobre 2020).
- ^ (EN) Tricyclo[4.2.0.0(2,5)]octa-3,7-diene, (1α,2α,5α,6α),, su webbook.nist.gov. URL consultato l'8 agosto 2023.
- ^ (EN) Jingbai Li e Steven A. Lopez, Multiconfigurational Calculations and Nonadiabatic Molecular Dynamics Explain Tricyclooctadiene Photochemical Chemoselectivity, in The Journal of Physical Chemistry A, vol. 124, n. 38, 24 settembre 2020, pp. 7623–7632, DOI:10.1021/acs.jpca.0c05280. URL consultato l'8 febbraio 2024.
- ^ L. Cessar, P. E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane. In: J. Am. Chem. Soc. 92, 1972, S. 3515–3518, DOI: 10.1021/ja00714a075.
- ^ (EN) Philip E. Eaton, Mao-Xi Zhang e Richard Gilardi, Octanitrocubane: A New Nitrocarbon, in Propellants, Explosives, Pyrotechnics, vol. 27, n. 1, 2002-03, pp. 1–6, DOI:10.1002/1521-4087(200203)27:1<1::AID-PREP1>3.0.CO;2-6. URL consultato l'8 agosto 2023.
- ^ (EN) Min‐Hsien Liu e Chun‐Chih Lin, Theoretical modeling of the chemical synthesis and detonation performance of polynitrocubane derivatives, in International Journal of Quantum Chemistry, vol. 120, n. 5, 2020-03, DOI:10.1002/qua.26117. URL consultato il 24 gennaio 2023.
- ^ (EN) Tristan A. Reekie, Craig M. Williams e Louis M. Rendina, Cubanes in Medicinal Chemistry, in Journal of Medicinal Chemistry, vol. 62, n. 3, 14 febbraio 2019, pp. 1078–1095, DOI:10.1021/acs.jmedchem.8b00888. URL consultato l'8 agosto 2023.
- ^ (EN) S. Shi, W. Ji e S. H. Tang, Synthesis and Optical Limiting Capability of Cubane-like Mixed Metal Clusters (n-Bu4N)3[MoAg3BrX3S4] (X = Cl and I), in Journal of the American Chemical Society, vol. 116, n. 8, 1994-04, pp. 3615–3616, DOI:10.1021/ja00087a064. URL consultato l'8 agosto 2023.
- ^ (EN) L. S. Barbosa, E. Moreira e A. R. Lopes, Cubane and cubanoid: Structural, optoelectronic and thermodynamic properties from DFT and TD-DFT method, in Journal of Molecular Graphics and Modelling, vol. 103, 1º marzo 2021, pp. 107820, DOI:10.1016/j.jmgm.2020.107820. URL consultato l'8 agosto 2023.
- ^ (EN) Liqi Wang, Xujun Zheng e Tatiana B. Kouznetsova, Mechanochemistry of Cubane, in Journal of the American Chemical Society, vol. 144, n. 50, 21 dicembre 2022, pp. 22865–22869, DOI:10.1021/jacs.2c10878. URL consultato l'8 agosto 2023.
- ^ (EN) Philip E. Eaton e Thomas W. Cole, The Cubane System, in Journal of the American Chemical Society, vol. 86, n. 5, 1964-03, pp. 962–964, DOI:10.1021/ja01059a072. URL consultato l'8 febbraio 2024.
Bibliografia
modifica- (EN) H. Hopf, Classics in Hydrocarbon Chemistry: Syntheses, Concepts, Perspectives, Wiley, 2000, ISBN 978-3-527-29606-4.
- (EN) J. Law, A Dictionary of Science, Oxford University Press, 2017, ISBN 978-0-19-106919-2.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su cubano