Utente:Logrezzo/sandbox1
| Logrezzo/sandbox1 | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Cloruro di ossalile | |
| Nomi alternativi | |
| Cloruro di acido ossalico Dicloruro ossalile Dicloruro ossalico | |
| Caratteristiche generali | |
| Massa molecolare (u) | 126.93 g/mol |
| Aspetto | Liquido incolore |
| Numero CAS | |
| Proprietà chimico-fisiche | |
| Indice di rifrazione | 1.429 |
| Solubilità in acqua | Decompone |
| Temperatura di fusione | −16 °C |
| Temperatura di ebollizione | 63–64 °C (1.017 bar) |
| Indicazioni di sicurezza | |
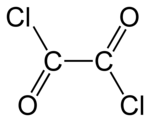
Il cloruro di ossalile è un composto chimico con formula (COCl)2. Questo liquido incolore dall'odore intenso è un utile reagente nella sintesi organica.[1] Può essere preparato trattando l'acido ossalico con pentacloruro di fosforo.[2]
Applicazioni nelle sintesi organiche
modificaSintesi di cloruri di acidi
modificaViene usato principalmente nelle sintesi organiche per la preparazioni di cloruri di acidi dai rispettivi acidi carbossilici. Il reagente, così come il cloruro di tionile, durante questa applicazione genera prodotti di scarto volatili:
Il cloruro di ossalile tende a essere un reagente più blando e selettivo. Una piccola quantità di Dimetilformammide viene solitamente aggiunta come catalizzatore della reazione.
Formylation of arenes
modificaOxalyl chloride reacts with aromatic compounds in the presence of aluminium chloride to give the corresponding acid chloride in a process known as a Friedel-Crafts acylation.[3][4] The resulting acid chloride can be hydrolysed in water to form the corresponding carboxylic acid.
Preparation of diesters
modificaLike other acid chlorides, oxalyl chloride reacts with alcohols to give esters:
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Typically such reactions are conducted in the presence of a base such as pyridine. The diester derived from phenol, phenyl oxalate ester, is Cyalume, the active ingredient in glow sticks.
Oxidation of alcohols
modificaThe combination of DMSO, oxalyl chloride and triethylamine converts alcohols to the corresponding aldehydes and ketones via the process known as the Swern oxidation.
Other
modificaOxalyl chloride was reportedly used in the first synthesis of dioxane tetraketone (C4O6), a novel oxide of carbon.[5]
Precautions
modificaAs with all acyl chlorides, oxalyl chloride reacts with water liberating HCl gas. Overall, its effects are comparable to those of phosgene.
In March 2000 a Malaysia Airlines Airbus A330 was damaged beyond repair after a falsely declared cargo of oxalyl chloride leaked into the cargo bay. [6]
References
modifica- ^ Salmon, R. "Oxalyl Chloride" in Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley & Sons, New York, DOI: 10.1002/047084289X.ro015.
- ^ Vogel, A.; Steffan, G.; Mannes, K.; Trescher, V. "Oxalyl chloride" DE 78-2840435 19780916.Chemical Abstracts Number 93:94818
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv7p0420.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=CV5P0706.
- ^ Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini and Hrvoj Vancik, The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger’s elusive ethanedioic (oxalic) acid anhydride, in J. Chem. Soc., Perkin Trans. 1, n. 16, 1998, pp. 2553–2558, DOI:10.1039/a803430c.
- ^ Firm told to pay $65 mln for ruining plane, Reuters, 6 dicembre 2007. URL consultato il 6 dicembre 2007.