Esteri
Gli esteri (al sing. estere) sono composti organici prodotti dalla reazione, detta "esterificazione", di un alcol o di un fenolo con un acido carbossilico o un suo derivato. Tale termine fu introdotto dal chimico Leopold Gmelin (1788-1853).[1]
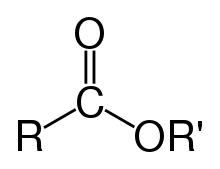
Vengono denominati esteri anche i prodotti dell'acilazione degli alcoli con altri acidi inorganici, che danno origine alla famiglia degli esteri inorganici, che hanno proprietà chimiche molto simili agli esteri organici ma la cui struttura caratteristica è leggermente diversa da questa. La nomenclatura degli esteri segue quella dei sali degli acidi reagenti, quindi avremo, per esempio:
- CH3COOC2H5 acetato di etile;
- C15H31COOCH3 palmitato di metile;
Gli esteri a basso peso molecolare hanno odore gradevole, fruttato; gli altri invece sono inodori. Esteri naturali di elevato peso molecolare sono i grassi e le cere, quest'ultime formate da grassi superiori e da alcoli monovalenti a catena lunga.
Sintesi modifica
- Esterificazione di Fischer:
OH OR' | --> | R-C=O + H+ + R'OH <-- R-C=O +H2O + H+
È una reazione di equilibrio, quindi per migliorare la quantità di prodotto ottenuta si usa l'alcol direttamente come solvente, in maniera tale che sia in eccesso e che spinga la reazione verso i prodotti. Questo implica che l'alcol sia composto, al massimo, da tre atomi di carbonio, altrimenti non riesce più a sciogliere l'acido carbossilico.
- Ottenimento da cloruri acilici:
Cl OR' | | R-C=O + R'OH --> R-C=O + HCl
La reazione si esegue in piridina, che svolge tre compiti: fa da solvente, neutralizza l'acido cloridrico che si forma e scioglie il cloruro acilico come complesso attivato, ovvero rende più facile la formazione del prodotto.
- Ottenimento da anidridi:
R-C=O | O OR' OH | | | R-C=O + R'OH --> R-C=O + R-C=O
Anche in questo caso la reazione si esegue in piridina per le ragioni già citate sopra; unica differenza è che si forma acido acetico anziché acido cloridrico.
- Ottenimento con diazometano:
È una reazione con rese molto alte, che solitamente si esegue in soluzione eterea; ha però i difetti di costituire una sintesi solo per i metil esteri e di avere a che fare con un composto estremamente pericoloso.
Avviene in due stadi:
- 1. Trasferimento di un protone dal gruppo carbossilico al diazometano:
- 2. Reazione di Sn2, dove l'anione carbossilato è il nucleofilo e l'azoto è l'ottimo gruppo uscente:
Reazioni tipiche modifica
Le reazioni chimiche tipiche degli esteri sono tutte di sostituzione nucleofila, e precisamente sono la idrolisi acida o retro-Fisher, l'idrolisi basica o saponificazione, la alcolisi e la ammonolisi.
- Idrolisi acida (retro-Fisher):
Sostanzialmente si tratta della stessa reazione di formazione dell'estere, condotta però con pH solo debolmente acido. Riscaldando l'estere con acidi minerali diluiti, il doppio legame C=O viene protonato e si spezza, permettendo ad una molecola d'acqua di reagire con l'estere e riformando l'alcol originale e l'acido con un protone in più, che viene espulso rapidamente.
- Idrolisi basica (saponificazione):
Se invece di un acido diluito si fa reagire l'estere con una base forte e concentrata, questa si combina completamente e definitivamente con l'acido e l'estere scompare dalla soluzione, lasciando il posto al sale dell'acido e all'alcol di partenza, che dato il pH basico della soluzione non possono più combinarsi. Questa reazione viene detta anche saponificazione perché, se l'acido in questione è un derivato carbossilico a catena lunga (acidi grassi superiori), il composto risultante è precisamente il sapone di uso comune.
- Alcolisi o transesterificazione:
In questa reazione l'alcol originale dell'estere viene sostituito (spostato) da un altro, che ne prende il posto: è una reazione di equilibrio molto simile all'idrolisi acida, favorita da un pH acido, e si verifica in un gran numero di reazioni biochimiche. La formula di massima della reazione è:
Come nell'idrolisi acida, il processo ha inizio con la protonazione del legame C=O dell'estere, ma al posto dell'acqua è il secondo alcol presente nella soluzione a reagire. Poiché vengono favorite dallo stesso ambiente, la reazione di alcolisi si svolge in concorrenza con quella di idrolisi acida: quindi per avere una resa sufficiente è necessario usare una concentrazione molto alta dell'alcol da sostituire.
- Ammonolisi:
In questa reazione si usa l'ammoniaca per rompere il legame C=O dell'estere, ottenendo un alcol e una ammide.
La formula generale della reazione è:
dove R'-OH è l'alcol e R-CONH2 è l'ammide.
Classi di esteri modifica
Dal punto di vista biologico, gli esteri possono essere suddivisi in tre classi a seconda della lunghezza della catena di atomi di carbonio e del tipo di alcool e di acido.
- Esteri di frutta:
- Sono gli esteri più piccoli, in cui sia l'acido che l'alcol hanno una catena di meno di 10 atomi di carbonio; sono molto comuni nelle essenze di frutta, naturali e artificiali. Per esempio:
- CH3COOC2H5 acetato di etile (pera, mela, ribes e frutti di bosco).
- CH3COOC5H11 acetato di n-amile (banana, ananas, pera).
- C4H9COOC2H5 isovalerianato di etile (pesca, valeriana).
- Cere:
- Nelle cere le catene di carbonio, sia nell'acido che nell'alcol, sono più lunghe di 10 atomi (a volte più di 30): a volte sono di pari lunghezza. Alcuni classificano le cere nel gruppo dei lipidi semplici, insieme agli oli naturali e ai grassi.
- C15H31COOC16H33 palmitato di cetile (nel bianco di balena o spermaceti).
- C15H31COOC30H61 palmitato di miricile (cera d'api).
- Gliceridi:
- Sono senz'altro la classe di esteri più importante dal punto di vista biologico. L'alcol è sempre lo stesso, il glicerolo (detto anche 1,2,3-propantriolo o propantriolo), un alcol trivalente. Gli acidi che reagiscono con il glicerolo sono tutti a catena lunga (da 12 a 20 atomi di carbonio nell'uomo), monoinsaturi o polinsaturi, e monocarbossilici, cioè con un solo gruppo acido carbossile. Quindi si possono avere esteri monogliceridi, digliceridi o trigliceridi a seconda di quanti gruppi ossidrili del glicerolo vengono sostituiti (uno, due o tutti e tre). I componenti più noti dei gliceridi sono l'acido palmitico, l'acido stearico e l'acido oleico.
- I monogliceridi e i digliceridi possono essere otticamente attivi, se le loro molecole sono asimmetriche; gli 1,2-digliceridi sono interessanti biologicamente perché sono precursori chimici dei trigliceridi e dei fosfolipidi. Ma di gran lunga più importanti sono i trigliceridi, che costituiscono il gruppo più numeroso di lipidi semplici, cioè di quelle sostanze non solubili in acqua ma solubili nei solventi apolari.
Note modifica
- ^ Gmelin, Leopold nell'Enciclopedia Treccani, su treccani.it. URL consultato il 28 marzo 2022.
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «estere»
- Wikimedia Commons contiene immagini o altri file su estere
Collegamenti esterni modifica
- (EN) IUPAC Gold Book, "esters", su goldbook.iupac.org.
- Esperienze in laboratorio - Gli esteri, su itchiavari.org.
| Controllo di autorità | Thesaurus BNCF 23190 · LCCN (EN) sh85044949 · GND (DE) 4153062-7 · BNF (FR) cb11970080s (data) · J9U (EN, HE) 987007555690105171 · NDL (EN, JA) 00562050 |
|---|