Reagente di Lawesson
Il reagente di Lawesson è un composto organico usato in sintesi organica come agente tionante. È stato inizialmente reso popolare da Sven-Olov Lawesson che, però, non lo inventò. Il reagente di Lawesson è stato inizialmente sintetizzato nel 1956 durante uno studio sistematico delle reazioni con P4S10.[1]
| Reagente di Lawesson | |
|---|---|
 | |
 | |
| Nome IUPAC | |
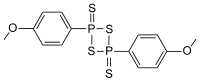
| 2,4-Bis(4-metossifenil)-1,3-ditio-2,4-difosfoetano-2,4-disolfuro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C14H14O2P2S4 |
| Massa molecolare (u) | 404,45 |
| Aspetto | polvere gialla chiara |
| Numero CAS | |
| Numero EINECS | 242-855-4 |
| PubChem | 87949 |
| SMILES | S=P1(SP(=S)(S1)c2ccc(OC)cc2)c3ccc(OC)cc3 |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Temperatura di ebollizione | 228-231 °C (442-448 °F; 501-504 K) |
| Indicazioni di sicurezza | |
| Frasi H | 261 - 302 - 332 |
| Consigli P | 231+232 - 261 - 264 - 270 - 271 - 280 - 301+312 - 304+340 - 312 - 330 - 402+404 - 501 |
Preparazione modifica
Il reagente di Lawesson è acquistabile. Può essere facilmente preparato in laboratorio riscaldando un miscuglio di anisolo e pentasolfuro di fosforo finché il miscuglio è trasparente e non si ha più la formazione di acido solfidrico[2], al che si ricristallizza dal toluene o dallo xilene.
Dato che il reagente di Lawesson ha un forte e sgradevole odore, è quindi meglio preparare il composto sotto una cappa aspirante e trattare tutta la vetreria utilizzata con una soluzione decontaminante prima di portarla fuori dalla cappa aspirante. Un metodo comune ed efficace di annullare i residui di odori è quello di usare un eccesso di ipoclorito di sodio.
Meccanismo d'azione modifica
Il reagente di Lawesson ha un anello ai cui quattro vertici si hanno atomi alternati di fosforo e zolfo. Con il riscaldamento, l'anello centrale di fosforo e zolfo si può aprire per formare due iluri ditiofosfati reattivi (R-PS2). La maggior parte della dinamica della reazione del reagente di Lawesson è infatti la dinamica di questi intermedi reattivi.
In generale, più un carbonile è ricco di elettroni, più velocemente il gruppo carbonilico sarà convertito nel tiocarbonile corrispondente dal reagente di Lawesson.
Usi modifica
La chimica legata al reagente di Lawesson e alle sostanze correlate è stata revisionata da alcuni gruppi.[3][4] L'uso principale del reagente di Lawesson è la tionazone dei composti carbonilici. Infatti, il reagente di Lawesson convertirà un carbonile in un tiocarbonile. Inoltre, il regente di Lawesson è stato usato per tionare enoni, esteri,[5] lattoni, ammidi, lattami e chinoni.
In uno studio, la reazione del maltolo con il reagente di Lawesson risulta in una sostituzione selettiva dell'ossigeno in due posizioni.[6]
Una combinazione di perclorato di argento e reagente di Lawesson ha la capacità di agire come un acido di Lewis ossofilico con la capacità di catalizzare la reazione di Diels-Alder dei dieni con le aldeidi α,β-insature.
Gli alcoli possono essere convertiti a tioli tramite trattamento con il reagente di Lawesson.[7]
Note modifica
- ^ H. Z. Lecher, R. A. Greenwood e K. C. Whitehouse, The Phosphonation of Aromatic Compounds with Phosphorus Pentasulfide, in Journal of the American Chemical Society, vol. 78, n. 19, 1º ottobre 1956, pp. 5018–5022, DOI:10.1021/ja01600a058. URL consultato il 4 marzo 2017.
- ^ THIATION WITH 2,4-BIS(4-METHOXYPHENYL)-1,3,2,4- DITHIADIPHOSPHETANE 2,4-DISULFIDE: N-METHYLTHIOPYRROLIDONE, in Organic Syntheses, vol. 62, DOI:10.15227/orgsyn.062.0158. URL consultato il 4 marzo 2017.
- ^ (EN) Mark St. John Foreman e J. Derek Woollins, Organo-P–S and P–Se heterocycles, in Journal of the Chemical Society, Dalton Transactions, n. 10, 1º gennaio 2000, pp. 1533–1543, DOI:10.1039/b000620n. URL consultato il 4 marzo 2017.
- ^ (EN) Martin Jesberger, Thomas P. Davis e Leonie Barner, Applications of Lawesson’s Reagent in Organic and Organometallic Syntheses, in Synthesis, vol. 2003, n. 13, 1º settembre 2003, pp. 1929–1958, DOI:10.1055/s-2003-41447. URL consultato il 4 marzo 2017 (archiviato dall'url originale il 5 giugno 2018).
- ^ Brian A. Jones e Jerald S. Bradshaw, Synthesis and reduction of thiocarboxylic O-esters, in Chemical Reviews, vol. 84, n. 1, 1º febbraio 1984, pp. 17–30, DOI:10.1021/cr00059a002. URL consultato il 4 marzo 2017.
- ^ (EN) Daniel Brayton, Faith E. Jacobsen e Seth M. Cohen, A novel heterocyclic atom exchange reaction with Lawesson's reagent: a one-pot synthesis of dithiomaltol, in Chem. Commun., n. 2, 21 dicembre 2006, pp. 206–208, DOI:10.1039/b511966a. URL consultato il 4 marzo 2017.
- ^ (EN) Takehiko Nishio, A novel transformation of alcohols to thiols, in Journal of the Chemical Society, Chemical Communications, n. 4, 1º gennaio 1989, DOI:10.1039/c39890000205. URL consultato il 4 marzo 2017.
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su Reagente di Lawesson