Adenosina trifosfato
L'adenosintrifosfato (o ATP) è un ribonucleotide formato da una base azotata, cioè l'adenina, dal ribosio, che è uno zucchero pentoso, e da tre gruppi fosfato. È uno dei reagenti necessari per la sintesi dell'RNA, ma soprattutto è il collegamento chimico fra catabolismo e anabolismo e ne costituisce la "corrente energetica". Esso viene idrolizzato ad ADP (adenosindifosfato), che viene riconvertito in ATP mediante vari processi.
| Adenosina trifosfato | |
|---|---|
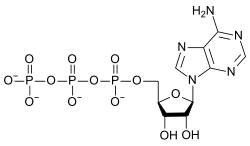 | |
| Nome IUPAC | |
| [(2R,3S,4R,5R)-5-(6-amminopurin-9-il)-3,4-diidrossiossolan-2-il]metil(idrossifosfonoossifosforil)idrogeno fosfato | |
| Abbreviazioni | |
| ATP | |
| Nomi alternativi | |
| Adenosina 5-(tetraidrogeno trifosfato) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H16N5O13P3 |
| Massa molecolare (u) | 507,18 |
| Numero CAS | |
| Numero EINECS | 200-283-2 |
| PubChem | 5957 |
| DrugBank | DBDB00171 |
| SMILES | C1=NC2=C(C(=N1)N)N=CN2C3C(C(C(O3)COP(=O)(O)OP(=O)(O)OP(=O)(O)O)O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | 3,2×10−7 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |

L'ATP è il composto ad alta energia richiesto dalla quasi totalità delle reazioni metaboliche endoergoniche. Esso viene prodotto secondo la reazione di condensazione endoergonica:
L'ATP non può stare libero nel citosol ma deve essere chelato (stabilizzato) dal magnesio. Esso maschera parzialmente le cariche negative e influenza la conformazione nello spazio dei gruppi fosfato.
Dalla respirazione, in cui si libera energia, una parte molto piccola di essa (30,5 kJ/mol) viene immagazzinata nelle molecole di ATP. L'immagazzinamento vero e proprio avviene quando la fosfocreatina cede alla molecola di ADP un gruppo fosfato che appunto le mancava per divenire ATP. Mentre si uniscono gruppo fosfato e ADP, l'energia viene imprigionata nei nuovi legami chimici: adesso avremo finalmente la molecola di ATP.
Energia di idrolisi dell'ATP
modificaL'ATP dona energia mediante reazione di idrolisi, mediata dall'enzima ATPasi, che nella maggior parte dei casi coinvolge il trasferimento di un gruppo fosfato.
ATP4− + H2O → ADP3− + Pi + H+con una variazione di energia libera di −30,5 kJ/mol (esoergonica)
L'energia che si libera viene subito utilizzata grazie ad enzimi che attuano reazioni che ne richiedono.
Nell'ATP c'è una tensione repulsiva tra gli atomi di ossigeno dei gruppi fosfato che a pH 7 sono ionizzati. La forza di repulsione non è sufficiente a rompere il legame perché l'energia di attivazione è più elevata. Questi gruppi fosfato obbligano i due atomi di ossigeno carichi negativamente ad avvicinarsi fra loro, generando una forte repulsione. La presenza di ioni idronio derivati dalle molecole d'acqua crea un legame col gruppo fosfato terminale dell'ATP, generando una violenta repulsione fra gli ioni ossigeno che porta alla rottura del primo legame del gruppo fosfato con formazione di ADP.
Partecipazione dell'ATP nei processi di energetizzazione delle molecole
modificaSono poche le reazioni dove l'ATP dona energia a una molecola tramite idrolisi, principalmente fornisce energia alle altre molecole per trasferimento di gruppi fosfato. L'idrolisi in sé produce solo la liberazione di calore che non può essere usato in sistemi omeotermi. ATP può dunque o donare un gruppo fosforico o donare l'Adenilato. I gruppi fosfato che possono subire un attacco sono 3:
- attacco nucleofilo in posizione γ con rimozione di un gruppo
- attacco nucleofilo in posizione β con rimozione di due gruppi → pirofosfato
- attacco nucleofilo in posizione α con rimozione di pirofosfato e trasferimento di adenilato
Questa ultima reazione si chiama adenilazione, il pirofosfato rilasciato con un'adenilazione viene poi scisso in due gruppi singoli dalla pirofosfatasi inorganica:
PPi → 2Picon una variazione di energia libera di −19,5 kJ/mole (esoergonica)
L'adenilazione è fondamentale per portare l'acido grasso a un livello energetico superiore preparandolo così al suo legame con il trasportatore.
Note
modifica- ^ Sigma Aldrich; rev. dell'11.10.2012 riferita al sale bisodico idrato
Voci correlate
modificaAltri progetti
modifica- Wikizionario contiene il lemma di dizionario «adenosintrifosfato»
- Wikimedia Commons contiene immagini o altri file sull'adenosina trifosfato
Collegamenti esterni
modifica- adenosintrifosfato, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- ATP, in Dizionario delle scienze fisiche, Istituto dell'Enciclopedia Italiana, 1996.
- ATP, in Enciclopedia della scienza e della tecnica, Istituto dell'Enciclopedia Italiana, 2007-2008.
- Andrea Carfi e Laura Fontana, ATP, in Dizionario di medicina, Istituto dell'Enciclopedia Italiana, 2010.
- (EN) adenosine triphosphate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 47124 · LCCN (EN) sh85000850 · GND (DE) 4143345-2 · BNF (FR) cb122660296 (data) · J9U (EN, HE) 987007292950205171 · NDL (EN, JA) 00560059 |
|---|
