RNA interference
La RNA interference (dall'inglese interferenza dell'RNA, abbreviata comunemente come RNAi) è un meccanismo mediante il quale alcuni frammenti di RNA sono in grado di interferire (e spegnere) l'espressione genica.
La RNAi si distingue da altri fenomeni di silenziamento genetico, dal momento che in Caenorhabditis elegans è stata osservata essere in grado di diffondere da cellula a cellula e di essere ereditabile. Ciò è stato osservato anche nelle piante, oltre che nei mammiferi ma, nell'ultimo caso con minore efficienza, e solo nei primi stadi dello sviluppo embrionale. Si distingue quindi tra meccanismi coinvolgenti molecole a doppio filamento, RNA interference in senso stretto, mediate da molecole come Short interfering RNA e fenomeni coinvolgenti miRNA, a singolo filamento.
Storia
modificaPrima che la RNAi fosse ben caratterizzata, i diversi fenomeni di silenziamento genico legati all'RNA erano indicati con vari nomi, come silenziamento genico post-trascrizionale, silenziamento genico indotto da virus, co-soppressione dell'espressione genica o silenziamento transgenico. In seguito alla caratterizzazione completa del processo, è stato chiaro che questi due fenomeni fossero in realtà espressione dello stesso meccanismo.
L'uso dell'RNA per ridurre l'espressione genica nelle piante è stata una procedura comunemente usata per molti anni. RNA antisenso a singolo filamento venivano introdotti nelle cellule vegetali che si appaiavano con l'RNA messaggero a singolo filamento ad esso complementare. Mentre gli scienziati credevano inizialmente che il doppio filamento di RNA risultante dall'appaiamento non potesse venir tradotto in una proteina, è ora chiaro che l'RNA a doppio filamento avvia invece il meccanismo dell'interferenza. L'uso di RNA a doppio filamento è diventato più diffuso dopo la scoperta del meccanismo molecolare dell'RNAi, inizialmente in petunia, più tardi in Caenorhabditis elegans. Nel 1990 Jorgensen la scopre, introducendo transgeni responsabili della pigmentazione della petunia per ottenere petunie più scure, viola intenso. Accade però che la pigmentazione è inspiegabilmente ridotta del 40% nelle petunie transgeniche che diventarono addirittura più chiare; e una ridotta espressione del gene endogeno oltre che del transgene (cosoppressione)
Il processo molecolare
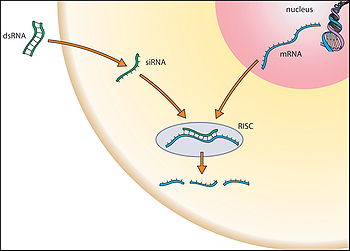
modificaLa RNAi è un processo specifico e potente portato avanti dalla cellula. Sebbene non tutti i dettagli del processo stesso siano ancora chiari, sembra che il cosiddetto macchinario dell'RNAi, una volta individuata una molecola di RNA a doppio filamento (dsRNA), sia in grado di avviare il meccanismo della RNAi.
- Attraverso un enzima (chiamato Dicer), la sequenza di dsRNA è tagliata in frammenti di lunghezza minore (19-21 paia di basi).
- Il breve frammento di dsRNA (chiamato short interfering RNA, o siRNA) si associa ad un complesso enzimatico denominato RISC (dall'inglese RNA induced silencing complex, complesso silenziatore indotto dal Rna).
- L'RNA a doppio filamento viene aperto, probabilmente da una elicasi: solo il filamento di RNA antisenso rimane associato a RISC, mentre il filamento senso viene degradato.
- La RISC è ora attiva: è in grado di scansionare molti mRNA presenti nel citosol fino a trovarne uno complementare al frammento di RNA antisenso associato al complesso stesso.
- Se l'appaiamento tra siRNA e mRNA è perfetto (o quasi perfetto), una componente della RISC (detta argonaute protein o Argo) è in grado di operare un taglio sull'mRNA. I due frammenti di mRNA risultanti, privo di cappuccio al 5' uno e di coda di poliA al 3' l'altro, vengono così rapidamente degradati dalle RNAsi della cellula stessa. Se l'appaiamento, invece, non è perfetto, si pensa che la RISC sia comunque in grado di inibire la traduzione del gene. Sebbene il meccanismo di questo secondo evento non sia chiaro, sembra che possa essere molto diffuso negli animali.
Funzione e significato evolutivo
modificaIl meccanismo della RNAi è ampiamente utilizzato nel silenziamento dell'espressione genica: è stato osservato che certe regioni genomiche codificano per alcune brevi molecole di RNA (dette genericamente microRNA), in grado di ripiegarsi a formare una forcina (si parla in questo caso di short hairpin RNA, o shRNA). Quando gli enzimi della RNAi individuano tali molecole, le processano come precedentemente detto, quindi sono in grado di portare alla degradazione tutti gli mRNA complementari presenti nel citosol. La riduzione della presenza degli mRNA ha come ovvia conseguenza il calo di sintesi della proteina da essi codificata. Questo meccanismo è stato inizialmente individuato come JAW microRNA in Arabidopsis thaliana: questo RNA è coinvolto nella regolazione di alcuni geni che controllano la forma della pianta. In seguito, sono stati individuati numerosi altri microRNA dal meccanismo simile in numerosi organismi eucarioti (più di 300).
Un altro possibile significato della RNAi può essere legato al fatto che il ciclo vitale e replicativo di molti virus comprende un passaggio durante il quale il genoma virale è costituito di dsRNA. Ciò induce a pensare che il sistema della RNAi si sia evoluto anche per rispondere alle infezioni virali.
La RNAi è stata anche legata a numerosi processi cellulari, come la formazione della struttura del centromero[1] e della eterocromatina[2].
La scoperta
modificaLa rivoluzionaria scoperta della RNAi avvenne per caso in seguito ad esperimenti in corso su organismi vegetali negli USA e nei Paesi Bassi a cavallo tra gli anni ottanta e gli anni novanta[3]. In particolare, i ricercatori stavano lavorando sulla produzione di fiori di Petunia con colorazione più vivace. Per raggiungere questo scopo, introdussero nelle piantine alcune copie aggiuntive di un gene noto per codificare un enzima chiave nella colorazione dei petali. Sorprendentemente, molte piantine così trattate non presentavano gli attesi colori intensi ma erano privi di colore. Attraverso un'analisi più precisa, i ricercatori furono in grado di scoprire che sia il gene endogeno che il transgene erano stati soppressi. Per questo motivo, il fenomeno fu inizialmente definito come co-soppressione dell'espressione genica: il meccanismo molecolare, in ogni caso, rimaneva ignoto.
Alcuni anni più tardi, alcuni virologi vegetali fecero un'osservazione simile. Le loro ricerche erano indirizzate all'individuazione dei meccanismi di resistenza delle piante contro i virus. In quel periodo si era dimostrato che le piante erano in grado di produrre proteine specifiche virali. Queste proteine erano in grado di rendere le piante tolleranti o resistenti alle infezioni virali. In ogni caso, essi osservarono che, sorprendentemente, anche le piante aventi solo brevi frammenti degli RNA codificanti per quelle proteine erano in grado di resistere alle infezioni virali. Essi conclusero che tali molecole di RNA fossero in grado di attaccare i virus, inibendone la replicazione e la diffusione attraverso la pianta. Agendo in senso inverso, provarono in seguito ad introdurre brevi sequenze geniche all'interno dei virus che infettano piante. Allo stesso modo, in seguito all'infezione con questi virus, le piante non erano più in grado di produrre proteine dai quegli specifici geni. I ricercatori chiamarono questo fenomeno silenziamento genico indotto da virus (o VIGS, dall'inglese virus-induced gene silencing). I fenomeni individuati fino a questo punto furono denominati silenziamento genico post-trascrizionale[4].
In seguito a queste osservazioni iniziali, molti laboratori iniziarono a ricercare il processo molecolare alla base di queste manifestazioni. Nel 1998 gli statunitensi Andrew Fire e Craig Mello iniettarono RNAds all'interno di Caenorhabditis elegans, un verme nematode, individuando un potente effetto di silenziamento. Il termine RNA interference fu coniato in questa occasione[5].
Nel 2006 Fire e Mello hanno vinto il Premio Nobel per la medicina e fisiologia per i loro lavori nel campo della RNA interference.
Silenziamento genico
modificaLa RNAi sta avendo un numero crescente di applicazioni nel campo dell'ingegneria genetica. In particolare, la RNAi viene utilizzata per silenziare selettivamente l'espressione genica al limite di qualunque gene. Questi studi, chiamati di loss of function, permettono di identificare il ruolo di un determinato gene attraverso il suo spegnimento. Il meccanismo della RNAi, da questo punto di vista, risulta molto ben adattabile a questo tipo di finalità. La RNAi, oltretutto, permette di svolgere studi di loss of function senza eliminare fisicamente un gene (un processo definito knock-out): lo spegnimento mediato da RNAi, infatti, è genericamente definito knock-down. I vantaggi di questa modalità consistono tra l'altro nella possibilità di ripristinare l'attività del gene silenziato (attraverso l'utilizzo di sistemi di transgenesi condizionale)[6].
La maggior parte delle applicazioni della RNAi sono state portate avanti su organismi modello come Caenorhabditis elegans ed il moscerino della frutta Drosophila melanogaster[7][8]. C. elegans è particolarmente utile negli studi su e con RNAi, dal momento che gli effetti del silenziamento genico su questo organismo sono generalmente ereditabili e perché l'inserimento dall'esterno di RNAds è particolarmente semplice. Attraverso un meccanismo i cui dettagli non sono ancora ben noti, infatti, è possibile servirsi di batteri come Escherichia coli per trasferire RNA nell'organismo. C.elegans viene nutrito con questi batteri, che così trasferiscono RNA al verme direttamente nel tratto intestinale dell'animale. Questo processo è molto efficiente e veloce, nonché molto meno oneroso dei metodi tradizionali, come l'inserimento dell'animale in una soluzione contenente l'RNA da trasferire o l'iniezione dello stesso RNA nelle gonadi dell'animale[9].
Applicazioni in medicina
modificaIl dsRNA che avvia la RNAi può essere utilizzato come farmaco. La prima applicazione in questo senso a raggiungere i trial clinici è stata quella per il trattamento per la degenerazione maculare. La RNAi è anche stata dimostrata essere molto efficace nella reversione del danno epatico in modelli animali murini. Un altro utilizzo possibile di questi farmaci potrebbe essere quello di repressori di geni essenziali di numerosi patogeni (batterici o virali). In questo modo, come avviene del resto già per la maggior parte dei farmaci in commercio, il patogeno non sarebbe in grado di sopravvivere. La RNAi, ad esempio, si è dimostrata efficace nel silenziamento dei geni di HIV in un modello della malattia in topo.
Dal momento che la RNAi interferisce solo con molecole di acido nucleico già trascritte (e non direttamente con il DNA), essa potrebbe avere un interessante sviluppo nel campo della terapia genica. I sostenitori delle terapie a base di RNAi, infatti, ricordano che queste non solleverebbero tutti i dubbi etici che attualmente un qualsiasi intervento sul DNA sembra comportare: i farmaci ad RNA, infatti, sarebbero considerati dall'opinione pubblica alla stregua dei farmaci attualmente in uso. Per questo motivo, la RNAi e le terapie basate sulla RNAi stanno attraendo un numero sempre maggiore di industrie farmaceutiche e biotecnologiche.
Note
modifica- ^ (EN) Volpe TA et al - Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi - Science. 2002 Sep 13;297(5588):1818-9
- ^ (EN) Schramke V et al - Hairpin RNAs and retrotransposon LTRs effect RNAi and chromatin-based gene silencing - Science. 2003 Aug 22;301(5636):1060-1
- ^ (EN) Napoli C., Lemieux C., and Jorgensen R. (1990) "Introduction of a chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans". Plant Cell 2: 279-289 Archiviato l'8 maggio 2006 in Internet Archive.
- ^ (EN) Dehio C. and Schell J. (1994). "Identification of plant genetic loci involved in a post transcriptional mechanism for meiotically reversible transgene silencing". Proceedings of the National Academy of Sciences of the United States of America 91 (12): 5538-5542 Archiviato l'8 maggio 2006 in Internet Archive.
- ^ (EN) Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature 391: 806-11
- ^ (EN) Chang HS et al, Using siRNA technique to generate transgenic animals with spatiotemporal and conditional gene knockdown Am J Pathol. 2004 Nov;165(5):1535-41 Archiviato il 5 dicembre 2005 in Internet Archive.
- ^ (EN) Dzitoyeva S et al, Gamma-aminobutyric acid B receptor 1 mediates behavior-impairing actions of alcohol in Drosophila: adult RNA interference and pharmacological evidence, Proc Natl Acad Sci U S A. 2003 Apr 29;100(9):5485-90 Archiviato l'8 maggio 2006 in Internet Archive.
- ^ (EN) Dzitoyeva S et al, Identification of a novel Drosophila gene, beltless, using injectable embryonic and adult RNA interference (RNAi), BMC Genomics. 2003 Aug 12;4(1):33 Archiviato l'8 maggio 2006 in Internet Archive.
- ^ (EN) Fortunato A et al, ncover genetic interactions in Caenorhabditis elegans by RNA interference, Biosci Rep. 2005 Oct-Dec;25(5-6):299-307
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su RNA interference
Collegamenti esterni
modifica- (EN) Animazione del processo della RNAi, dal sito della rivista Nature
- (EN) Planting the Seeds of a New Paradigm, review su PLos (Public Library of Science) riguardante la RNAi
- (EN) RNAi:The Long and Short of It, una presentazione della RNAi, con ampia bibliografia
- (EN) Discovery of RNA Interference presentazione della RNAi (richiede Flash)
- (EN) Database degli siRNA, su rnainterference.org. URL consultato il 12 luglio 2006 (archiviato dall'url originale il 18 ottobre 2005).
- (EN) Latest research Ultime novità sulla RNA interference, su techbio.info. URL consultato il 12 luglio 2006 (archiviato dall'url originale il 19 agosto 2006).
- (EN) Navigating journey of genome to medicine Archiviato il 29 giugno 2005 in Internet Archive., articolo sull'International Herald Tribune
- (EN) Video di 15 minuti che spiega i principi alla base della RNAi, della rete pubblica statunitense PBS
- (EN) RNA interference Database[collegamento interrotto], contenente dati fenotipici ottenuti dagli studi sulla RNAi in C. elegans