Bicarbonato d'ammonio
Il bicarbonato d'ammonio (o idrogenocarbonato d'ammonio) è un sale acido dell'ammoniaca e dell'acido carbonico, avente formula NH4HCO3 o [NH4]+[HCO3]−.
| Bicarbonato d'ammonio | |
|---|---|
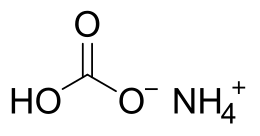 | |
| Nomi alternativi | |
| idrogenocarbonato d'ammonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (NH4)HCO3 |
| Massa molecolare (u) | 79,06 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 213-911-5 |
| PubChem | 14013 |
| DrugBank | DBDB15925 |
| SMILES | N.O=C(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,586 g/cm³ |
| Solubilità in acqua | 220 g/L (20 °C) |
| Temperatura di fusione | 106 °C (379 K) (in capillare chiuso) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 |
| Consigli P | --- [1] |
Proprietà
modificaIl bicarbonato di ammonio è un composto salino termodinamicamente molto stabile, ΔHƒ° = -849,4 kJ/mol,[2] ma molto poco stabile cineticamente. A temperatura ambiente si presenta come un solido incolore o polvere bianca dall'odore lieve di ammoniaca. Si può preparare passando un flusso di CO2 in soluzione acquosa di idrossido di sodio; raffreddando la soluzione si separa il sale, che si può ricristallizzare e ottenere come cristalli rombici incolori.[3][4]
È molto solubile in acqua, dove si scioglie assorbendo calore (processo endotermico) e la sua soluzione acquosa è debolmente basica. È praticamente insolubile in alcool, acetone ed acetato di etile.[4]
A temperature superiori a 35 °C si decompone producendo fumi di ammoniaca:
NH4HCO3 → NH3 + CO2 + H2O
Reagisce velocemente con acidi, basi forti e forti ossidanti. Con acidi, dalla reazione si producono i corrispondenti sali di ammonio, oltre ad anidride carbonica ed acqua:
NH4HCO3 + HCl → NH4Cl + CO2 + H2O
Reagisce con una mole di base forte come NaOH svolgendo ammoniaca e dando bicarbonato di sodio in soluzione:
NH4HCO3 + NaOH → NaHCO3 + H2O + NH3 ↑
La reazione con i solfati dei metalli alcalino-terrosi porta alla precipitazione dei rispettivi carbonati e formazione di solfato di ammonio:
CaSO4 + 2 NH4HCO3 → CaCO3 + (NH4)2SO4 + CO2 + H2O
Reagisce con gli alogenuri alcalini dando i rispettivi bicarbonati e il corrispondente alogenuro di ammonio:
Applicazioni
modificaViene utilizzato nell'industria alimentare come agente lievitante nella preparazione di dolciumi o come regolatore di acidità (ha sigla E503) e viene usato anche negli estintori e come agente di rigonfiamento in materiali plastici porosi.
Note
modifica- ^ scheda del bicarbonato d'ammonio su IFA-GESTIS
- ^ (EN) CRC Handbook of Chemistry and Physics, 97ª ed., CRC Press, 24 giugno 2016, 5-4, DOI:10.1201/9781315380476, ISBN 978-1-315-38047-6. URL consultato l'8 ottobre 2024.
- ^ Dale L. Perry, Handbook of inorganic compounds, 2. ed, CRC Press/Taylor & Francis, 2011, 179, ISBN 978-1-4398-1461-1.
- ^ a b ammonium hydrogen carbonate, su chemister.ru. URL consultato l'8 ottobre 2024.
Bibliografia
modifica- Dario Bressanini, La scienza della pasticceria: la chimica del bignè, Milano, Gribaudo, 2022, ISBN 978-88-580-1230-7.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su bicarbonato d'ammonio
| Controllo di autorità | Thesaurus BNCF 36781 · LCCN (EN) sh2008000090 · J9U (EN, HE) 987007537613005171 |
|---|

