Procaina
La procaina è un farmaco anestetico a uso locale. Il cloridrato della procaina è commercializzato con il nome di Novocaina.
| Procaina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
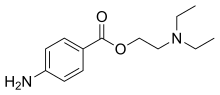
| 4-amminobenzoato di 2-(N,N-dietil)-amminoetile | |
| Nomi alternativi | |
| 4-amminobenzoato di 2-(dietilammino)-etile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C13H20N2O2 |
| Massa molecolare (u) | 236.31 |
| Numero CAS | |
| Numero EINECS | 200-426-9 |
| Codice ATC | N01 |
| PubChem | 4914 |
| DrugBank | DBDB00721 |
| SMILES | O=C(OCCN(CC)CC)c1ccc(N)cc1 |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 288 K | 8,1 |
| Dati farmacologici | |
| Categoria farmacoterapeutica | anestetici |
| Dati farmacocinetici | |
| Metabolismo | idrolisi dalle esterasi del plasma |
| Emivita | 40-84 secondi |
| Escrezione | renale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 301 - 317 |
| Consigli P | 280 - 301+310 [1] |
È un solido cristallino di colore bianco appartenente agli alcaloidi costituito da un estere dell'acido para-aminobenzoico. Dal punto di vista chimico è un derivato sintetico della cocaina, della quale serba l'azione paralizzante sulle strutture nervose sensitive periferiche.
Oggi viene utilizzato solo per anestesie da infiltrazione o come bloccante nervoso a scopo diagnostico.[2] Tuttavia alcuni soggetti ipersensibili a questa sostanza possono sviluppare affezioni cutanee (ad esempio l'orticaria).
La procaina viene metabolizzata per la maggior parte tramite idrolisi nei tessuti, mentre la parte restante subisce una degradazione enzimatica a livello epatico, come la cocaina. Per questo motivo, presenta una breve durata d'azione ma una tossicità minore rispetto alla cocaina.
La procaina fu sintetizzata per la prima volta nel 1905,[3] dal chimico tedesco Alfred Einhorn. È stata introdotta in medicina dal chirurgo Heinrich Braun nel 1909.[4]
Farmacologia
modificaLa procaina è un anestetico. Agisce principalmente come bloccante dei canali del sodio.[5]
Oggi viene usata principalmente come anestetico dentale, perché è stata soppiantata da alternative più efficaci (e ipoallergeniche) come la lidocaina. Come gli altri anestetici locali, la procaina è un vasodilatatore, quindi viene somministrata insieme all'epinefrina, che d vasocostrizione. La vasocostrizione aiuta a ridurre il sanguinamento, aumenta la durata e la qualità dell'anestesia, impedisce al farmaco di raggiungere la circolazione sistemica in grandi quantità e riduce la quantità di anestetico richiesta.[6] A differenza della cocaina, la procaina non dà euforia, che crea dipendenza e aumenta il rischio di abuso.
La procaina è un estere, quindi viene metabolizzata nel plasma dagli enzimi pseudocolinesterasi attraverso l'idrolisi in acido para-amino benzoico (PABA), che viene poi escreto dai reni nelle urine.
La procaina viene usata occasionalmente come additivo nelle droghe illegali, come la cocaina. I produttori di MDMA usano la procaina come additivo, in rapporti che vanno dall'1 al 10% di MDMA e fino al 90% di procaina.[7]
Sintesi
modificaLa procaina può essere sintetizzata in due modi.[8]
- Il primo consiste nella reazione diretta dell'estere etilico dell'acido 4-aminobenzoico con il 2-dietilamminoetanolo in presenza di etossido di sodio.
- Il secondo è ossidando il 4-nitrotoluene in acido 4-nitrobenzoico, che viene poi fatto reagire con cloruro di tionile. Il cloruro acido risultante viene esterificato con 2-dietilamminoetanolo per dare nitrocaina. Infine, il gruppo nitro viene ridotto mediante idrogenazione.
Effetti avversi
modificaLa procaina deprime l'attività neuronale. La depressione porta a irrequietezza, tremori e convulsioni lievi o gravi. Studi sugli animali hanno dimostrato che l'uso di procaina aumenta i livelli di dopamina e serotonina nel cervello.[9] Possono verificarsi altri problemi legati alla tolleranza individuale ai diversi dosaggi. Nervosismo e vertigini derivano dall'eccitazione del sistema nervoso centrale che, in caso di sovradosaggio, porta a insufficienza respiratoria. La procaina può anche indurre un indebolimento del miocardio con conseguente aumento del rischio di arresto cardiaco.[10]
La procaina può causare reazioni allergiche con relativi problemi di respirazione, eruzioni cutanee e gonfiore. Le reazioni allergiche alla procaina di solito non sono in risposta alla procaina stessa, ma al suo metabolita PABA. Sono piuttosto rare, si stima che abbiano un'incidenza di 1 su 500.000 iniezioni. Circa uno su 3000 nordamericani bianchi è omozigote (cioè ha due copie del gene anormale) per la forma atipica dell'enzima pseudocolinesterasi, e non idrolizza anestetici come la procaina.[11][12] Ciò comporta una permanenza maggiore dell'anestetico nel sangue e quindi un aumento della tossicità.
Storia
modificaLa procaina fu sintetizzata per la prima volta nel 1905,[3] poco dopo l'amilocaina. È stata creata dal chimico tedesco Alfred Einhorn che ha dato alla sostanza chimica il nome commerciale Novocaina, dal latino nov- (che significa "nuovo") e -caina , un suffisso comune per tutti gli alcaloidi usati come anestetici. È stata introdotta in medicina dal chirurgo Heinrich Braun nel 1909[4] per essere utilizzata in odontoiatria e chirurgia, data la bassa potenza e durata di azione.
Note
modifica- ^ Sigma Aldrich; rev. del 03.08.2012 riferita al cloridrato
- ^ (EN) How long does Novocaine last?, su medicalnewstoday.com, 22 maggio 2018. URL consultato il 29 luglio 2020.
- ^ a b Sigmund Freud e Richard Woodley, Sulla Cocaina / La cocaina in America, collana Grandi Tascabili Economici Newton, Newton Compton Editori, p. 298, ISBN 978-88-541-1940-6.
- ^ a b "Introduzione alla Chimica Farmaceutica" seconda edizione, Graham L. Patrick, pag 233.
- ^ Procaine, su drugbank.ca. URL consultato il 29 luglio 2020.
- ^ A. L. Sisk, Vasoconstrictors in local anesthesia for dentistry, in Anesthesia Progress, vol. 39, n. 6, 1992, pp. 187–193. URL consultato il 29 luglio 2020.
- ^ EcstasyData.org: Results : Lab Test Results for Recreational Drugs, su drugsdata.org. URL consultato il 29 luglio 2020.
- ^ Alfred Einhorn, Karl Fiedler e Carl Ladisch, Ueber p-Aminobenzoësäurealkaminester, in Justus Liebigs Annalen der Chemie, vol. 371, n. 2, 1º gennaio 1909, pp. 142–161, DOI:10.1002/jlac.19093710204. URL consultato il 29 luglio 2020.
- ^ K. Sawaki e M. Kawaguchi, Some correlations between procaine-induced convulsions and monoamines in the spinal cord of rats, in Japanese Journal of Pharmacology, vol. 51, n. 3, 1989-11, pp. 369–376, DOI:10.1254/jjp.51.369. URL consultato il 29 luglio 2020.
- ^ (EN) Novocain - FDA prescribing information, side effects and uses, su Drugs.com. URL consultato il 29 luglio 2020.
- ^ Ombregt, Ludwig,, A system of orthopaedic medicine, Third edition, ISBN 978-0-7020-5295-8, OCLC 857890247. URL consultato il 29 luglio 2020.
- ^ OMIM Entry - * 177400 - BUTYRYLCHOLINESTERASE; BCHE, su omim.org. URL consultato il 29 luglio 2020.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su procaina
| Controllo di autorità | Thesaurus BNCF 46440 · BNF (FR) cb11944205x (data) |
|---|