Carbonato di sodio
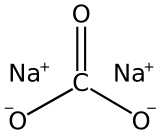
Il carbonato di sodio è un sale di sodio dell'acido carbonico, di formula Na2CO3. Nel carbonato entrambi gli ioni idrogeno dell'acido sono stati sostituiti da ioni sodio, a differenza dell'idrogenocarbonato di sodio.
| Carbonato di sodio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossocarbonato di disodio | |
| Nomi alternativi | |
| soda Solvay | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CNa2O3 e Na2CO3 |
| Peso formula (u) | 105,99 |
| Aspetto | solido cristallino bianco |
| Numero CAS | |
| Numero EINECS | 207-838-8 |
| PubChem | 10340 e 516885 |
| DrugBank | DBDB09460 |
| SMILES | C(=O)([O-])[O-].[Na+].[Na+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,53 |
| Solubilità in acqua | 220 g/l a 293 K (20 °C) |
| Temperatura di fusione | 851 °C |
| Temperatura di ebollizione | si decompone |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −1130,7 |
| ΔfG0 (kJ·mol−1) | −1044,4 |
| S0m(J·K−1mol−1) | 135 |
| C0p,m(J·K−1mol−1) | 112,3 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 319 |
| Consigli P | 260 - 305+351+338 [1] |
Il carbonato di sodio in passato è stato chiamato a lungo soda, da non confondere con la soda caustica (nome tradizionale dell'idrossido di sodio).
A temperatura ambiente si presenta come una polvere cristallina bianca, molto solubile in acqua, dando una soluzione decisamente basica. Per riscaldamento tende a decomporsi liberando biossido di carbonio gassoso (calcinazione).
In chimica è un moderato reagente alcalinizzante. Sciolto in acqua produce una soluzione basica; una soluzione di 50 g in un litro di acqua a 25 °C ha pH 11,5.
Inserito tra gli additivi alimentari codificati dall'Unione europea con la sigla E 500, trova impiego nella fabbricazione del vetro, di prodotti quali silicato e fosfati di sodio, nell'industria della carta e nella produzione di detergenti. Nella produzione di alimenti è utilizzato nei prodotti dolciari per coadiuvare la fermentazione dell'impasto: produce un'alveolatura dei prodotti fine e regolare.
Produzione
modificaFino all'inizio del XIX secolo veniva prodotto dalla combustione di una pianta alofita, la Salsola soda.
Processo Leblanc
modificaIl chimico Nicolas Leblanc nel 1792 sviluppò il primo processo sintetico per la produzione di soda secondo le due reazioni:
Tuttavia tale processo ebbe vita breve, infatti da fine Ottocento alla seconda metà del XX secolo il 91% della produzione industriale del carbonato di sodio avvenne tramite il processo messo a punto nel 1861 dal chimico belga Ernest Solvay, da cui il nome soda Solvay, che converte il cloruro di sodio in carbonato di sodio usando carbonato di calcio e ammoniaca. È significativo anche l'apporto dato dal chimico Ludwig Mond il quale riuscì a far funzionare a livello industriale su larga scala la geniale proposta di Ernest Solvay, grazie a continue migliorie sull'impianto di Winnington, come ricorda il figlio Alfred Mond nei suoi scritti sulla vita del padre. Di fatto, Ludwig Mond era tenuto in grandissima considerazione, tra gli altri, da Langner, col quale lavorò, e da Lord Kelvin. Questi miglioramenti hanno reso produttivi gli impianti tanto che alcuni vorrebbero chiamare questo processo come Solvay-Mond. La vera importanza di questo processo risiede nell'aver abbassato i costi della soda che quale venne e viene adoperata per la produzione di maggiori quantità di saponi e detergenti, con gli immaginabili benefici dal punto di vista igienico-sanitario.
La produzione di soda sintetica sta rapidamente ridimensionandosi. Negli Stati Uniti è stato chiuso l'ultimo impianto nel 1986 e molti altri stabilimenti, specie nella zona del Pacifico, stanno seguendo la stessa sorte. La causa è il minerale trona, un bicarbonato di sodio biidrato, molto diffuso nel mondo e i cui giacimenti principali oggi sfruttati sono proprio negli Stati Uniti e in Turchia[2].
Processo Solvay
modificaSul fondo del reattore viene scaldato il carbonato di calcio, che si decompone liberando biossido di carbonio
Dall'alto viene immessa nel reattore una soluzione concentrata di cloruro di sodio e ammoniaca; il biossido di carbonio, gorgogliando, fa precipitare l'idrogenocarbonato di sodio
L'idrogenocarbonato di sodio viene quindi convertito in carbonato di sodio per riscaldamento, liberando acqua e diossido di carbonio
mentre l'ammoniaca viene rigenerata per trattamento del cloruro d'ammonio formatosi con la calce viva (l'ossido di calcio) residua della decomposizione del carbonato di calcio
Dato che l'ammoniaca viene completamente riciclata, solo la salamoia (il cloruro di sodio) ed il calcare (il carbonato di calcio) vengono consumati e l'unico prodotto di scarto è il cloruro di calcio.
Produzione dalla trona
modificaIl bacino di Green River nel Wyoming è il più grande fra quelli sinora noti. Scoperto nel 1938 durante esplorazioni petrolifere, contiene più di cento miliardi di tonnellate equivalenti di soda, una quantità in grado di soddisfare un secolo di consumo dell'intera Italia.
La trona viene estratta meccanicamente, anche se nel corso del Novecento sono state brevettate senza successo pratico diverse tecniche dette “a solvente” che utilizzerebbero acqua per la dissoluzione del minerale e la successiva estrazione.
Dopo l'estrazione il minerale viene calcinato e frantumato per ottenere la soda grezza, ricca di impurità del minerale originario. Quindi si passa alla purificazione che consiste nella dissoluzione, filtrazione e ricristallizzazione del carbonato di sodio monoidrato; il processo prende appunto il nome del monoidrato.
Note
modifica- ^ scheda del carbonato di sodio su IFA-GESTIS
- ^ La Chimica e l'Industria, marzo 1998, pp209-210
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su carbonato di sodio
Collegamenti esterni
modifica- (EN) sodium carbonate / washing soda, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 38541 · LCCN (EN) sh2003005847 · GND (DE) 4171245-6 · J9U (EN, HE) 987007556741805171 |
|---|