Acido fluoridrico
[[1]]
| Acido fluoridrico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| fluoruro di idrogeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HF |
| Massa molecolare (u) | 20,01 |
| Aspetto | gas incolore |
| Numero CAS | |
| PubChem | 16211014 e 14917 |
| DrugBank | DB11072 |
| SMILES | F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,97 (liquido) |
| Costante di dissociazione acida (pKa) a 298 K | 3,17 |
| Costante di dissociazione acida a 298 K | 6,7×10−4 |
| Solubilità in acqua | 100% in peso |
| Temperatura di fusione | −83 °C (190 K) |
| Temperatura di ebollizione | 19,5 °C (294 K) |
| Tensione di vapore (Pa) a 294 K | 1,034×106 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −273,3 |
| ΔfG0 (kJ·mol−1) | −275,4 |
| S0m(J·K−1mol−1) | 173,8 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1 276 ppm /1h (ratto) (inal.)[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 300 - 310 - 330 - 314 - EUH071 |
| Consigli P | 260 - 262 - 280 - 304+340 - 302+350 - 303+361+353 - 305+351+338 - 315 - 405 - 403 [2] |
L'acido fluoridrico (nome IUPAC: fluoruro di idrogeno) è un acido minerale relativamente debole, gassoso a temperatura ambiente, incolore, molto velenoso; la sua formula chimica è . I suoi sali vengono chiamati fluoruri.
Il fluoruro d'idrogeno, , è il composto che sta alla base di tutta l'industria dei composti fluorurati e da esso trae origine tutta la vasta gamma dei composti fluorurati organici e inorganici oggi in commercio. È disponibile in forma anidra sotto forma di gas compresso liquefatto oppure sciolto in soluzione acquosa. Il fluoruro di idrogeno anidro è corrosivo, pericoloso, fumante e provoca gravi ustioni per contatto.
Caratteristiche modifica
Molto solubile in acqua, forma con essa un azeotropo in cui è contenuto in ragione del 38,2%. Tale azeotropo bolle a 112 °C.
È il più debole acido alogenidrico. Questo comportamento è dato dal fatto che ha il raggio atomico molto piccolo: ciò porta ad avere gli elettroni su orbitali molto ravvicinati tra di loro. Per diventare un acido deve (in accordo con la teoria acido-base di Lewis) accettare un doppietto elettronico e trasformarsi in anione . Qui entrano in gioco le forze repulsive degli orbitali di valenza e , così elevate che cede elettroni e riformare l'acido spostando l'equilibrio verso i reagenti.[3]
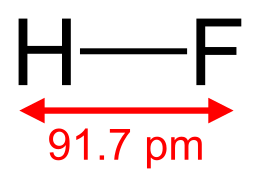
Inoltre, il legame originato dalla sovrapposizione degli orbitali dell'idrogeno con gli orbitali del fluoro, avendo dimensioni simili, tenderà ad avere migliore sovrapposizione, rispetto a quella che si origina tra gli orbitali atomici rispettivamente di cloro, bromo e iodio con l' dell'idrogeno, e quindi legami più forti. Infatti la lunghezza di legame è pari a 0,917 Å (la più bassa tra gli acidi alogenidrici) e energia di legame pari a 136 kcal/mole (la più alta tra gli acidi alogenidrici).
La sua acidità aumenta notevolmente quando la concentrazione è vicina al 100%. Ciò è dato dall'effetto dell'omoassociazione, in accordo con la reazione:
L'elevata elettronegatività del fluoro (è l'elemento più elettronegativo di tutti) rende il legame estremamente polare: unita alle piccole dimensioni degli atomi, consente a due o più molecole di acido fluoridrico puro in fase gassosa di formare degli aggregati (con che varia da a ) in cui le molecole sono tenute insieme da legami a idrogeno. Particolarmente stabile e ben documentato è il dimero , che tende a formare i sali idrogenodifluoruro.
Tale aggregazione si riflette nel suo punto di ebollizione, estremamente maggiore a quello degli altri acidi alogenidrici (cloridrico, bromidrico, iodidrico); lo stesso fenomeno spiega anche il più elevato punto di ebollizione dell'acqua rispetto a quello dell'acido solfidrico, che a temperatura ambiente è un gas. Allo stato solido e allo stato liquido ha una struttura concatenata e forma angoli di 134°. Si formano dei legami a idrogeno lungo gli assi dei doppietti solitari.
Storia modifica
- Nel 1771 Scheele dimostra che i gas liberati dalla reazione fra la fluorite e l'acido solforico intaccano il vetro.
- Nel 1780 Meyer e Wenzel sintetizzano una soluzione acquosa di acido fluoridrico usando un'apparecchiatura di metallo.
- Nel 1808 Gay Lussac e Thenard producono acido fluoridrico gassoso puro.
- Nel 1810 Ampère scopre la formula dell'acido fluoridrico.
- Nel 1856 Frémy ricava acido fluoridrico gassoso puro dalla decomposizione termica dell'idrogenodifluoruro di potassio .
- Nel 2021 tracce di acido fluoridrico sono state rilevate nelle nubi di gas della galassia NGP-190387 distante oltre 12 miliardi di anni luce.[4]
Sintesi modifica
I primi studi sulla reazione per produrre fluoruro d'idrogeno anidro a livello commerciale sono datati 1764.
Sostanzialmente, sebbene migliorato dal punto di vista progettuale e ingegneristico, il processo è rimasto fino a oggi lo stesso.
L'acido fluoridrico viene ottenuto industrialmente per azione dell'acido solforico sui fluoruri minerali come ad esempio la fluorite, la criolite o la fluorapatite a una temperatura intorno ai 250 °C:
All'impianto si alimenta , oleum o (anidride solforica). Si tende a lavorare con eccesso di acido solforico in modo da spingere la reazione verso i prodotti, tuttavia troppo acido produce peci di reazione umide, appiccicose, corrosive e difficili da gestire. A causa delle impurezze inevitabilmente presenti nel materiale di partenza si ha la formazione di sottoprodotti quali l'acido fluorosilicico da silice . Composti come l'ossido ferroso , l'ossido di magnesio , il carbonato di calcio e materiali organici in generale consumano acido solforico e oleum. I composti del fosforo, arsenico e boro necessitano di attrezzature speciali per essere rimossi mentre la presenza di ioni cloruro aumenta la corrosività dell' nei confronti delle apparecchiature.
Applicazioni modifica
Anche se l'acido fluoridrico era noto già agli inizi del XIX secolo, l'impiego industriale di fu limitato all'incisione del vetro e alla produzione di sostanze chimiche come fluoruro di sodio e bifluoruro di sodio. La seconda guerra mondiale ha portato una rivoluzione nel campo delle applicazioni dell' : la necessità di catalizzatori di alchilazione per produrre benzine a elevato numero di ottani per i carburanti avio, la nascita dell'industria nucleare che richiede esafluoruro di uranio e la rapida crescita del mercato dei clorofluorocarburi contribuirono a una costante e crescente domanda di fluoruro di idrogeno, in particolare in forma anidra[5].
Viene impiegato[6]
- Sin dal 1845 nella preparazione degli alogenuri alchilici ad esempio i CFC e gli HFC.
- Nella sintesi di monomeri fluorurati come il tetrafluoroetene.
- Nella produzione di alluminio nella sintesi di crioliti sintetiche .
- Nella purificazione del tantalio e del niobio.
- Nell'industria nucleare nel processo di arricchimento dell'uranio ovvero nella sintesi di esafluoruro di uranio .
- È la materia prima per produrre fluoro per elettrolisi.
- Data la sua capacità di sciogliere quasi tutti gli ossidi, trova impiego anche per rimuovere tracce di ossidi dalle superfici metalliche (ad esempio la pulizia del silicio nell'industria dei semiconduttori), nella produzione di lampadine smerigliate, nella marcatura di manufatti in vetro e come agente di decapaggio nell'industria siderurgica.
- Nell'industria petrolifera come catalizzatore per le reazioni di alchilazione per la produzione di benzine ad alto numero di ottano o di altri alchilati.
- Come agente di fluorurazione (sfruttando la reazione di metatesi) per la produzione di farmaci.
È uno dei pochi agenti corrosivi capaci di intaccare il vetro. Le soluzioni acquose di questo composto vengono pertanto conservate in contenitori in polietilene o teflon in grado di resistere all'azione estremamente corrosiva di quest'acido.
Viene conservato puro, sotto forma di gas liquefatto a bassa pressione, in bombole realizzate in monel. L'acido fluoridrico anidro si conserva altrettanto bene e viene commercializzato in bombole in acciaio.
Reagisce con il vetro trasformando la silice contenuta in tetrafluoruro di silicio secondo la reazione
La reazione, in presenza di una maggiore quantità di acido fluoridrico, può anche portare alla formazione di acido fluorosilicico:
In soluzione molto diluita, è disponibile come prodotto per rimuovere la ruggine e nella pulizia dei metalli, quali l'ottone.
Precauzioni modifica
L'acido fluoridrico corrode il vetro e diversi metalli. Per questa ragione viene comunemente conservato in contenitori in plastica (sebbene anche il PTFE sia moderatamente permeabile a esso). L'acido fluoridrico è estremamente tossico sia per inalazione della forma gassosa (IDLH = 30 ppm) sia per contatto con la soluzione acquosa; l'affinità dello ione fluoruro con gli ioni calcio e magnesio danneggia il tessuto osseo e le vie nervose. L'ingestione è spesso mortale. I primi sintomi di avvelenamento possono manifestarsi anche a distanza di 12 ore dal contatto con la sostanza, quando ormai può essere troppo tardi per intervenire, una circostanza che rende questo composto molto pericoloso. Nel 1979 lo scoppio di una bombola di questo gas all'Ausimont di Porto Marghera provocò 3 morti e 15 intossicati[7].
Le ustioni esterne da acido fluoridrico vengono trattate con creme a base di gluconato di calcio mentre per lesioni interne viene somministrato per via orale sotto forma di aerosol.
Note modifica
- ^ (EN) ChemIDplus:Hydrofluoric acid toxicity, su chem.sis.nlm.nih.gov (archiviato dall'url originale il 26 marzo 2010).
- ^ Scheda del fluoruro di idrogeno anidro su IFA-GESTIS, su gestis-en.itrust.de. URL consultato il 3 giugno 2021 (archiviato dall'url originale il 16 ottobre 2019).
- ^ QUESTION: IS HF A STRONG ACID OR A WEAK ACID?, su thoughtco.com.
- ^ Fabbriche di fluoro a ridosso del big bang, su media.inaf.it, 4 novembre 2021.
- ^ (EN) Kirk Othmer, Enciclopedia of Chemical Technology, vol. 11, 4ª ed., John Wiley & Sons.
- ^ eurofluor, su eurofluor.org.
- ^ Interpellanza 2/00173 presentata da Catalano (PDUP) in data 13 novembre 1979, su dati.camera.it, Camera dei deputati. URL consultato il 10 luglio 2015 (archiviato dall'url originale il 12 luglio 2015).
Voci correlate modifica
Altri progetti modifica
- Wikiquote contiene citazioni di o su acido fluoridrico
- Wikizionario contiene il lemma di dizionario «acido fluoridrico»
- Wikimedia Commons contiene immagini o altri file su acido fluoridrico
Collegamenti esterni modifica
- (EN) hydrofluoric acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 68229 · LCCN (EN) sh85063411 · GND (DE) 4209062-3 · BNF (FR) cb123062588 (data) · J9U (EN, HE) 987007533741505171 |
|---|
