Acetilcisteina
L’acetilcisteina è un derivato N-acetilato dell'amminoacido "solforato" cisteina.
| Acetilcisteina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
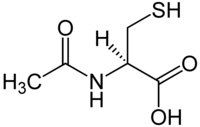
| acido 2R-acetammido-3-sulfanilpropanoico | |
| Nomi alternativi | |
| N-acetilcisteina acido (2R)-2-acetilammino-3-mercaptopropanoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H9NO3S |
| Massa molecolare (u) | 163,19 g/mol |
| Numero CAS | |
| Numero EINECS | 210-498-3 |
| Codice ATC | R05 |
| PubChem | 12035 |
| DrugBank | DBDB06151 |
| SMILES | O=C(O)[C@@H](NC(=O)C)CS |
| Dati farmacocinetici | |
| Biodisponibilità | 6–10% (orale) <3% (topico) |
| Metabolismo | epatico |
| Emivita | 5,6 ore (adulti) 11 ore (neonati) |
| Escrezione | renale |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
Presenta attività antiossidante e mucolitica ed è anche un antidoto salvavita in caso di eccessiva assunzione di paracetamolo (avvelenamento da paracetamolo). Inoltre si è riscontrato che può avere proprietà antiapoptotica, epatoprotettrice e nefroprotettrice.
Proprietà farmacologiche
modificaL'acetilcisteina è un mucolitico derivato da un amminoacido naturale "solforato" ad azione fluidificante sulle secrezioni mucose o mucopurulente delle vie respiratorie.
L'attività pronta e intensa dell'acetilcisteina sulla componente mucosa delle secrezioni è conseguente alla presenza nella molecola di un gruppo tiolico libero (-S-H) in grado di ridurre e scindere i ponti disolfuro (-S-S-) responsabili dell'aggregazione delle proteine e quindi dell'alta viscosità del muco. Invece l'attività dell'acetilcisteina sull'eventuale componente purulenta delle secrezioni è dovuta alla sua capacità di depolimerizzare gli acidi nucleici. L'acetilcisteina, modificando positivamente le caratteristiche qualitative e quantitative delle secrezioni delle vie aeree e favorendo il trasporto mucociliare, influisce in misura sostanziale sull'evoluzione e la risoluzione delle broncopneumopatie attenuando il rischio di complicanze da diminuzione di secreto e da insufficiente aerazione del polmone. Inoltre si suppone che l'acetilcisteina svolga un'azione di potenziamento del sistema antiossidante rappresentato dal tripeptide glutatione (GSH), uno dei più importanti meccanismi di difesa intracellulare. L'azione dell'acetilcisteina e quella del glutatione sono sinergiche nello stimolare l'attività dei linfociti T e dei macrofagi con positivi effetti immunitari, particolarmente desiderabili in caso di malattie respiratorie sostenute da virus e batteri. Nei confronti di questi ultimi, l'acetilcisteina è in grado di ridurre significativamente l'adesività alle cellule della mucosa e, promuovendo la sintesi cellulare del glutatione, è anche in grado di inattivare composti istolesivi quali le polveri e gli inquinanti atmosferici che vengono frequentemente inalati dal cavallo. L'acetilcisteina quale donatore di elettroni agisce da "scavenger" e antagonizza i radicali liberi dell'ossigeno, principali responsabili del fenomeno infiammatorio degenerativo del polmone del cavallo. Bloccando l'azione ossidante del radicale ipocloroso, l'acetilcisteina è in grado di proteggere l'alfa-1-antitripsina, efficace inibitore di elastasi e collagenasi, enzimi proteolitici che agiscono sulla parete alveolare determinando l'insorgenza dell'enfisema polmonare.
Meccanismo d'azione
modificaAntidoto
modificaL'utilizzo dell'acetilcisteina in caso d'avvelenamento da paracetamolo è dovuto alla sua capacità di rigenerare le scorte di glutatione a livello epatico. La cisteina, di cui l'acetilcisteina è sostanzialmente una forma di rilascio, è uno dei precursori del glutatione. A livello epatico il paracetamolo viene metabolizzato in N-acetilbenzochinonimmina, un metabolita in grado di indurre un notevole stress ossidativo e di legarsi covalentemente a molte proteine. A dosaggi terapeutici, l'N-acetilbenzochinonimmina viene prontamente coniugata con il glutatione formando un composto non tossico. Invece a elevate concentrazioni il glutatione non è sufficiente per cui, al fine di ripristinarne i livelli fisiologici, viene somministrata acetilcisteina ad alti dosaggi.
Attività mucolitica
modificaProbabilmente l'attività mucolitica dell'acetilcisteina è dovuta alla sua capacità di scindere i ponti disolfuro (-S-S-) tipici di molte proteine cicliche presenti nel muco (mucoproteine) e questo in ragione della presenza nella molecola di un gruppo tiolico libero (-S-H) in grado di interagire con questi legami responsabili dell'aggregazione delle proteine e quindi dell'alta viscosità del muco. Come risultato della scissione dei disolfuri in tioli, le molecole glicoproteiche vengono scisse in unità più piccole dotate di minore viscosità per cui vengono modificate le caratteristiche reologiche con conseguente più facile espettorazione. L'attività sulla componente purulenta delle secrezioni viene attribuita alla capacità di questo composto di depolimerizzare gli acidi nucleici.[2]
Attività antiossidante, protettiva e neuromodulatrice
modificaSempre per la sua attività antiossidante, vari studi hanno suggerito che l'acetilcisteina possa presentare altre azioni:
- Attività preventiva dell'uropatia emorragica da ciclofosfamide ed isofosfamide. A questo proposito, uno studio di Munshi e colleghi del 1992 ha concluso che l'attività di prevenzione dell'acetilcisteina nei confronti dell'uropatia indotta dall'isofosfamide è inferiore a quella del MESNA.[3]
- Attività di prevenzione della nefropatia conseguente all'uso di isofosfamide. In merito a questo punto, l'utilizzo dell'isofosfamide può determinare, specie in età pediatrica, la comparsa di disfunzioni renali del tipo Sindrome di Fanconi con perdita di amminoacidi, glucosio, fosfato, bicarbonato e proteine di basso peso molecolare e concomitante riduzione del tasso di filtrazione glomerulare. Ciò può determinare lo sviluppo di un'insufficienza renale cronica. Alcuni lavori in vitro ed in vivo su modelli murini hanno suggerito che l'acetilcisteina possa avere un ruolo nel prevenire questa complicanza.[4][5][6]
- Attività epatoprotettrice da alcolici e contaminanti ambientali.
- Attività neuromodulatoria in varie patologie psichiatriche, grazie all'attività inibitoria verso i recettori mGLuR2/3 dei terminali nervosi glutammatergici (risultando nella riduzione del rilascio sinaptico di glutammato). Inoltre, il glutatione può potenziare la risposta al glutammato dei recettori NMDA. Altre attività neuromodulatoria dell'acetilcisteina sono la riduzione della formazione di citochine infiammatorie, la riduzione di prodotti dello stress ossidativo e l'aumento dell'espressione di brain‐derived neurotrophic factor (BDNF) e B‐cell lymphoma 2 (BCL-2).[7][8]
Tossicità
modificaLa DL50 dopo somministrazione per via orale è superiore a 10 g/kg peso corporeo nel topo e nel ratto. A seguito di somministrazione endovenosa risulta di 4600 mg/kg nel topo e 2800 mg/kg nel ratto.[9] A ciò si aggiunga come la molecola in oggetto sia caratterizzata da una mancanza di accumulo di composti tiolici liberi o legati alle proteine a seguito di una ripetitività dei trattamenti nonché sprovvisto di interferenze sulla fertilità di effetti negativi peri e post natali e di potenzialità teratogena nel ratto e nel coniglio così come i risultati di un test di Ames in presenza e in assenza di S9 non delineano risvolti mutageni che rendano necessaria l'esecuzione di studi di cancerogenicità. Dagli studi condotti in merito, è possibile rilevare che anche a seguito di trattamenti non corretti non sia rilevato alcun rischio indiretto per i soggetti trattati, per la persona che lo somministra o per l'ambiente[10][11]
Indicazioni
modificaFluidificazione del muco
modificaIl farmaco viene utilizzato soprattutto come mucolitico espettorante e in caso di deficit lacrimale. Esiste qualche studio pubblicato che indica la sua associazione favorevole con amiloride, per la fluidificazione dell'espettorato vischioso in pazienti con fibrosi cistica.
Avvelenamento da paracetamolo
modificaIl farmaco è considerato un salvavita in caso di sovradosaggio di paracetamolo soprattutto per evitare lo sviluppo dell'epatite fulminante conseguente. Viene anche utilizzato per trattare l'insufficienza renale che si ritiene compaia nell'1-2% dei casi di avvelenamento da paracetamolo, talora anche in assenza d'epatopatia.[12] Al contrario, altri autori sostengono che l'aumento di glutatione a livello renale possa favorire, anziché ridurre, il danno renale.[13][14]
Nefropatia da mezzo di contrasto
modificaAlcuni studi hanno concluso che l'acetilcisteina potrebbe venir utilizzata quale fattore protettivo contro la nefropatia causata dall'uso dei mezzi di contrasto in radiologia[15][16][17], fenomeno che negli Stati Uniti d'America viene ritenuto avere un'incidenza dello 0,5% con tasso di mortalità che può arrivare al 35%[18]. In particolare, si è visto che i mezzi di contrasto possono alterare l'emodinamica renale e provocare anche necrosi tubulare. Questo fenomeno sembra essere dovuto alla formazione di specie reattive dell'ossigeno e in effetti studi su topi hanno indicato un aumento della perossidazione lipidica in conseguenza dell'uso di questi agenti[15].
Autori d'altri lavori hanno espresso delle perplessità a riguardo dell'efficacia dell'uso dell'acetilcisteina come fattore preventivo nella nefropatia da mezzo di contrasto[18][19].
In oculistica
modificaIn campo oftalmologico è usata per il trattamento di disturbi dovuti a deficit lacrimale con o senza alterazione della componente mucosale, come cheratocongiuntiviti e cheratopatie.
Cistite emorragica
modificaL'acetilcisteina è stata usata per il trattamento di cistiti emorragiche indotte da ciclofosfamide, grazie alla sua capacità di diminuire l'efficacia della ciclofosfamide[20][21].
Psichiatria
modificaL'acetilcisteina è stata sperimentata con successo nel trattamento della schizofrenia, dei disturbi acuti dell'umore (depressione, mania, ipomania[22]) nell'ambito del disturbo bipolare e del disturbo depressivo,[23] tricotillomania, dermatillomania, autismo, disturbo ossessivo-compulsivo[7], farmacodipendenza e dipendenza da droghe (tra cui nicotina, cannabis, metanfetamina, cocaina, etc.), gioco d'azzardo patologico[24][25][26].
Indicazioni in medicina veterinaria
modificaIn medicina veterinaria, per gli equidi, esistono alcuni farmaci a base di acetilcisteina (Equimucil) le cui indicazioni terapeutiche riguardano fondamentalmente le affezioni a carico dell'apparato respiratorio, in fase acuta, cronica e di esacerbazione, in cui la molecola viene utilizzata come mucolitico espettorante. La presenza di acetilcisteina in associazione con antibiotici (Equimucil antibiotico: Tiamfenicolo glicinato acetilcisteinato) non crea alcun problema per ciò che concerne l'eventuale insorgenza di fenomeni di resistenza batterica, anzi ne agevola l'efficacia terapeutica in determinate forme patologiche grazie alla sua azione mucolitica.
Agricoltura
modificaUno studio pubblicato nel 2013 ha investigato il possibile ruolo della N-acetilcisteina[27] per il trattamento delle infezioni da Xylella fastidiosa, un microrganismo fitopatogeno che è all'origine di gravi patologie dell'apparato xilematico, tra cui la malattia di Pierce, la Clorosi variegata degli agrumi (CVC), il Complesso del disseccamento rapido dell'olivo (CoDiRO), di una vasta gamma di specie di interesse agroalimentare. Lo studio, condotto su coltivazioni idroponiche in condizioni molto vicine a quelle sul campo, ha mostrato una significativa riduzione della popolazione batterica grazie alle capacità del farmaco di sciogliere i legami che garantiscono la coesione dei biofilm microbici. Si tratta della prima evidenza di un'attività antibatterica della NAC contro un microorganismo patogeno dei vegetali.
L'abbattimento della popolazione microbica dovuta al trattamento causa una netta riduzione dei sintomi, ma non estirpa in modo definitivo l'infezione. La recrudescenza dei sintomi sulle foglie dopo l'interruzione del trattamento avviene in un tempo di latenza aumentato fino a circa 8 mesi[27].
Off-Label
modificaL'acetilcisteina riduce inoltre i livelli plasmatici di omocisteina; potrebbe perciò potenzialmente risultare benefica nei pazienti con omocistinuria, che sono ad alto rischio tromboembolico.[28].
L'acetilcisteina su un modello animale mostra di inibire l'attività dei fibromiociti cardiaci causa di fibrosi cardiaca in corso di cardiomiopatia ipertrofica[29]. Quest'attività è correlata anche a meccanismi che coinvolgono le MMPs (Metallo Proteine di Matrice Zinco dipendenti) in particolare le collagenasi[30]. All'azione sulla collagenasi si somma anche un effetto sulle PGE2 e sull'IL-1β, con positivi effetti sulla cartilagine articolare[31].
Le azioni dell'acetilcisteina si esplicano sulla pelle, con un'azione di inibizione (scavenging) dei ROS (Radicali Liberi dell'Ossigeno), i quali sono anche causa di aumento di collagenasi e MMPs in genere[32]; l'aumento dei ROS comporta una precoce invecchiamento delle strutture profonde della pelle[33].
Alcuni studi hanno suggerito che l'acetilcisteina possa essere utilizzata nella terapia eradicativa dell'infezione da Helicobacter pylori. Il farmaco sembra agire, tramite la sua azione mucolitica, riducendo il muco gastrico che ricopre e protegge il batterio, favorendo l'azione battericida degli antibiotici utilizzati[34][35][36].
Effetti collaterali ed indesiderati
modificaIn alcuni pazienti in corso di trattamento sono stati segnalati cefalea, sonnolenza, nausea, vomito, talvolta diarrea, disgeusia e tinnito. In rari casi si sono verificate reazioni da ipersensibilità ed in particolare rash cutaneo e orticaria. L'acetilcisteina può indurre rinorrea e broncospasmo. Per questo motivo deve essere somministrata con attenzione ai soggetti asmatici, anziani o debilitati, o comunque affetti da disturbi o insufficienza respiratoria perché il farmaco potrebbe esacerbare l'ostruzione delle vie aeree. Il sorbitolo presente come eccipiente delle forme farmaceutiche può provocare disturbi gastrointestinali inclusa la diarrea.
Controindicazioni
modificaIl farmaco è controindicato nei soggetti con ipersensibilità nota al principio attivo oppure ad uno qualsiasi degli eccipienti della formulazione farmacologica. Inoltre è controindicato nelle donne in stato di gravidanza e nelle donne che allattano al seno. Le compresse e le bustine contengono aspartame pertanto sono controindicate nei soggetti affetti da fenilchetonuria. La presenza di sorbitolo fra gli eccipienti delle forme farmaceutiche ne controindica l'utilizzo nei soggetti con intolleranza ereditaria al fruttosio.
Diverse ricerche sembrano evidenziare che l'assunzione extra di antiossidanti (come appunto la N-acetilcisteina) attraverso l'uso di integratori alimentari da parte di pazienti affetti da tumori provochi l'accelerazione del processo di metastasi[37][38]).
Dosi terapeutiche
modifica- Trattamento affezioni dell'albero respiratorio
Il dosaggio consigliato nei soggetti adulti è di 600 mg (equivalenti ad una compressa o bustina oppure a 15 ml di sciroppo) una volta al giorno, preferibilmente alla sera. Il trattamento richiede in genere una durata di 5-10 giorni.
- Avvelenamento da paracetamolo: per via orale è utile iniziare con un dosaggio di 150 mg/kg di peso corporeo da somministrare il prima possibile e comunque entro 10 ore dall'assunzione dell'agente tossico. Successivamente si somministrano dosi singole di 70 mg/kg di peso corporeo, ogni 4 ore per almeno 3 giorni.
Nell'intossicazione da paracetamolo è in genere preferita la via di somministrazione endovenosa. La dose iniziale endovena nell'adulto è pari a 150 mg/kg di acetilcisteina in 200 mL di soluzione glucosata al 5%. L'infusione deve avere una durata di almeno 15 minuti. Successivamente si somministrano 50 mg/kg in 500 ml di soluzione glucosata al 5% per le successive 4 ore ed infine 100 mg/kg in 1000 ml di soluzione glucosata al 5% per ulteriori 16 ore.
- Deficit lacrimale, utilizzare 3-4 volte al giorno
Dosi terapeutiche in medicina veterinaria
modificaVia orale: trattamento iniziale (3-5 giorni): 20 mg/kg/die (pari a 1 bustina al dì di Equimucil ogni 125 kg di peso vivo); trattamento di mantenimento (7-10 giorni): 10 mg/kg/die (pari a ½ bustina al dì ogni 125 kg di peso vivo di Equimucil granulato). Via endovenosa: 5–10 mg/kg/die per 5-15 giorni (pari a 1,2-2,5 ml/die per 50 kg di peso vivo di Equimucil iniettabile).
Interazioni
modificaLa somministrazione contemporanea di acetilcisteina e carbone attivato comporta una riduzione della concentrazione plasmatica massima del fluidificante.
L'acetilcisteina può essere assunta in contemporanea al paracetamolo: sebbene ne sia un antidoto, essa agisce su un suo metabolita di scarto e non sul paracetamolo.
Note
modifica- ^ Sigma Aldrich; rev. del 27.04.2012
- ^ 27 Ballarini G., et al. (1971). Nuova Veterinaria, 47 (3) 151
- ^ Munshi NC, Loehrer PJ Sr, Williams SD, Langefeld C, Sledge G, Nichols CR, Roth BJ, Neuman A, Walsh WB, Einhorn LH., Comparison of N-acetylcysteine and mesna as uroprotectors with ifosfamide combination chemotherapy in refractory germ cell tumors., in Invest New Drugs., vol. 10, n. 3, agosto 1992, pp. 159-163, PMID 1428725.
- ^ Chen N, Aleksa K, Woodland C, Rieder M, Koren G., N-Acetylcysteine prevents ifosfamide-induced nephrotoxicity in rats., in Br J Pharmacol., vol. 153, n. 7, aprile 2008, pp. e1364-72, PMID 18278066.
- ^ Chen N, Aleksa K, Woodland C, Rieder M, Koren G., The effect of N-acetylcysteine on ifosfamide-induced nephrotoxicity: in vitro studies in renal tubular cells., in Transl Res., vol. 150, n. 1, luglio 2007, pp. e51-57, PMID 17585863.
- ^ Chen N, Aleksa K, Woodland C, Rieder M, Koren G., Prevention of ifosfamide nephrotoxicity by N-acetylcysteine: clinical pharmacokinetic considerations., in Can J Clin Pharmacol., vol. 14, n. 2, luglio 2007, pp. e246-50, PMID 17652768.
- ^ a b (EN) Massimo Carollo, Nicola Carollo e Giulia Montan, The promise of N ‐acetylcysteine in the treatment of obsessive‐compulsive disorder, in CNS Neuroscience & Therapeutics, vol. 30, n. 2, 2024-02, pp. e14653, DOI:10.1111/cns.14653. URL consultato il 7 marzo 2024.
- ^ Olivia Dean, Frank Giorlando e Michael Berk, N-acetylcysteine in psychiatry: current therapeutic evidence and potential mechanisms of action, in Journal of Psychiatry & Neuroscience, vol. 36, n. 2, 1º marzo 2011, pp. 78–86, DOI:10.1503/jpn.100057. URL consultato il 7 marzo 2024.
- ^ RE. Johnston, HC. Hawkins; JH. Weikel, The toxicity of N-acetylcysteine in laboratory animals., in Semin Oncol, vol. 10, 1 Suppl 1, marzo 1983, pp. 17-24, PMID 6682250.
- ^ 28 EMEA, (1998). Committee for Veterinary Medicinal products, Acetylcysteine, Summary report.
- ^ 29 Villa R., (2004). Rapporto di valutazione relativo alla documentazione del dossier di registrazione della specialità medicinale veterinaria “Equimucil”, Facoltà di Medicina Veterinaria Università di Milano.
- ^ Kent R. Olson, Intossicazioni Acute: Veleni, Farmaci e Droghe, Springer Verlag, 1999, p. 8, ISBN 978-88-470-0030-8.
- ^ Mazer M, Perrone J., Acetaminophen-induced nephrotoxicity: pathophysiology, clinical manifestations, and management., in J Med Toxicol., vol. 4, n. 1, marzo 2008, pp. e2-6, PMID 18338302.
- ^ Jones AF, Vale JA., Paracetamol poisoning and the kidney., in J Clin Pharm Ther., vol. 18, n. 1, febbraio 1993, pp. e5-8, PMID 8473360.
- ^ a b Tepel M, van der Giet M, Schwarzfeld C, Laufer U, Liermann D, Zidek W, Prevention of radiographic-contrast-agent-induced reductions in renal function by acetylcysteine, in N. Engl. J. Med., vol. 343, n. 3, luglio 2000, pp. 180–4, PMID 10900277.
- ^ Marenzi G, Assanelli E, Marana I, et al, N-acetylcysteine and contrast-induced nephropathy in primary angioplasty, in N. Engl. J. Med., vol. 354, n. 26, giugno 2006, pp. 2773–82, DOI:10.1056/NEJMoa054209, PMID 16807414.
- ^ Kay J, Chow WH, Chan TM, Lo SK, Kwok OH, Yip A, Fan K, Lee CH, Lam WF, Acetylcysteine for Prevention of Acute Deterioration of Renal Function Following Elective Coronary Angiography and Intervention: A Randomized Controlled Trial, in JAMA the Journal of the American Medical Association, vol. 289, 2003, p. 553, DOI:10.1001/jama.289.5.553, PMID 12578487.
- ^ a b Hoffmann U, Fischereder M, Krüger B, Drobnik W, Krämer BK, The value of N-acetylcysteine in the prevention of radiocontrast agent-induced nephropathy seems questionable, in J. Am. Soc. Nephrol., vol. 15, n. 2, febbraio 2004, pp. 407–10, PMID 14747387.
- ^ Miner SE, Dzavik V, Nguyen-Ho P, et al, N-acetylcysteine reduces contrast-associated nephropathy but not clinical events during long-term follow-up, in Am. Heart J., vol. 148, n. 4, ottobre 2004, pp. 690–5, DOI:10.1016/j.ahj.2004.05.015, PMID 15459602.
- ^ (EN) Palma PC, Villaça Júnior CJ, Netto Júnior NR, N-acetylcysteine in the prevention of cyclophosphamide induced haemorrhagic cystitis, in International Surgery, vol. 71, n. 1, 1986, pp. 36–7, PMID 3522468.
- ^ (EN) Joseph Basler, Hemorrhagic Cystitis Treatment & Management, su eMedicine.
- ^ Magalhães, PV; Dean, OM; Bush, AI; Copolov, DL; Malhi, GS; Kohlmann, K; Jeavons, S; Schapkaitz, I; Anderson-Hunt, M; Berk, M, A preliminary investigation on the efficacy of N-acetyl cysteine for mania or hypomania, in The Australian and New Zealand Journal of Psychiatry, vol. 47, n. 6, giugno 2013, pp. 564–8, DOI:10.1177/0004867413481631, PMID 23493756.
- ^ N-acetylcysteine (NAC) Also Effective in Unipolar Depression, su Bipolar Network News, 14 novembre 2012. URL consultato il 1º marzo 2014.
- ^ Dodd, S; Dean, O; Copolov, DL; Malhi, GS; Berk, M, N-acetylcysteine for antioxidant therapy: pharmacology and clinical utility, in Expert Opinion on Biological Therapy, vol. 8, n. 12, dicembre 2008, pp. 1955–1962, DOI:10.1517/14728220802517901, PMID 18990082.
- ^ Berk, M; Malhi, GS; Gray, LJ; Dean, OM, The promise of N-acetylcysteine in neuropsychiatry, in Trends in Pharmacological Sciences, vol. 34, n. 3, marzo 2013, pp. 167–177, DOI:10.1016/j.tips.2013.01.001, PMID 23369637.
- ^ (EN) Ganesh Raghu, Michael Berk e Peter A. Campochiaro, The Multifaceted Therapeutic Role of N-Acetylcysteine (NAC) in Disorders Characterized by Oxidative Stress, in Current Neuropharmacology, vol. 19, n. 8, 2021-08, pp. 1202–1224, DOI:10.2174/1570159X19666201230144109. URL consultato il 7 marzo 2024.
- ^ a b (EN) Muranaka LS, Giorgiano TE, Takita MA, Forim MR, Silva LF, Coletta Filho HD, Machado MA, de Souza AA, N-acetylcysteine in agriculture, a novel use for an old molecule: focus on controlling the plant-pathogen Xylella fastidiosa, in PLoS One, vol. 23, 8(8):e72937, 23 agosto 2013, DOI:10.1371/journal.pone.0072937, PMC 3751844, PMID 24009716. URL consultato il 4 luglio 2016.
- ^ M Monti, L'ulcera cutanea: approccio multidisciplinare alla diagnosi ed al trattamento p.107, Springer, 2000, ISBN 978-88-470-0072-8.
- ^ Ali J. Marian, MD, FACC, Vinitha Senthil, PhD, Suet N. Chen, MS, and Raffaella Lombardi, MD, Antifibrotic Effects of Antioxidant N-Acetylcysteine in a Mouse Model of Human Hypertrophic Cardiomyopathy Mutation, in Published in final edited form as: J Am Coll Cardiol., 21;47(4), febbraio 2006, pp. 827–834, DOI:10.1016/j.jacc.2005.10.041.
- ^ Tyagi SC, Kumar S, Borders S., Reactive oxygen species produced by NADPH oxidase, xanthine oxidase, and mitochondrial electron transport system mediate heat shock-induced MMP-1 and MMP-9 expression, in J Cell Biochem., 61(1), 1996 Apr, pp. 139-51, PMID 8726363.
- ^ Roman-Blas JA, Contreras-Blasco MA, Largo R, Alvarez-Soria MA, Castañeda S, Herrero-Beaumont G., Eur J Pharmacol., 25;623(1-3), 2009 Nov, pp. 125-31, PMID 19765584.
- ^ (EN) Shin MH, Moon YJ, Seo JE, Lee Y, Kim KH, Chung JH.Free Radic Biol Med. 2008 Feb 15;44(4):635-45. Epub 2007 Nov 12. PMID 18036352
- ^ (EN) Wenk J,‡, Jutta Schuller, et al. Overexpression of Phospholipid-hydroperoxide Glutathione Peroxidase in Human Dermal Fibroblasts Abrogates UVA Irradiation-induced Expression of Interstitial Collagenase/Matrix Metalloproteinase-1 by Suppression of Phosphatidylcholine Hydroperoxide mediated NF-κB Activation and Interleukin-6 Release* JOURNAL OF BIOLOGICAL CHEMISTRY 2004 279;(44)45634–42.
- ^ (EN) Huynh, et al., N-acetylcysteine, a novel treatment for Helicobacter pylori infection., in Dig Dis Sci, vol. 49, n. 11-12, 2004, pp. 1853-61.
- ^ (EN) Gurbuz, et al., Effect of N-Acetyl Cysteine on Helicobacter pylori, in Southern Medical Journal, vol. 98, n. 11, 2005, pp. 1095-1097.
- ^ (EN) Cammarota, et al., Biofilm demolition and antibiotic treatment to eradicate resistant Helicobacter pylori: a clinical trial., in Clin Gastroenterol Hepatol, vol. 8, n. 9, 2010, pp. 817-820.
- ^ Troppi antiossidanti possono far crescere un tumore, su fondazioneveronesi.it.
- ^ (EN) Antioxidants Accelerate Lung Cancer Progression in Mice, su stm.sciencemag.org (archiviato dall'url originale il 22 gennaio 2021).
Bibliografia
modifica- British national formulary, Guida all’uso dei farmaci 4ª edizione, Lavis, agenzia italiana del farmaco, 2007.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su acetilcisteina
Collegamenti esterni
modifica- Pharmamedix I&B, su pharmamedix.com.