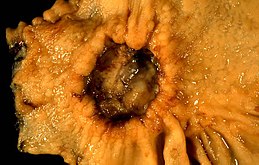
Tumore dello stomaco
Il tumore dello stomaco o tumore gastrico è una neoplasia che si sviluppa sul rivestimento dello stomaco.[1] I primi sintomi possono includere: sensazione di bruciore di stomaco, dolore all'addome superiore, nausea e perdita di appetito. I sintomi successivi possono includere: perdita di peso, ittero, vomito, difficoltà di deglutizione e sangue nelle feci.[2] Il tumore può diffondersi dallo stomaco in altre parti del corpo, soprattutto al fegato, ai polmoni, alle ossa e ai linfonodi.[3]
| Tumore dello stomaco | |
|---|---|
 | |
| Specialità | oncologia e gastroenterologia |
| Classificazione e risorse esterne (EN) | |
| OMIM | 137215 e 613659 |
| MedlinePlus | 000223 |
| eMedicine | 278744 |
La causa più comune è l'infezione del batterio Helicobacter pylori che rappresenta oltre il 60% dei casi.[4][5] Fattori di rischio comuni sono alcuni tipi di cibo e il tabagismo. Tra l'1% e il 3% dei casi sono dovuti a sindromi genetiche ereditarie. La maggior parte dei casi dei tumori allo stomaco sono carcinomi gastrici, essi possono essere divisi in un certo numero di sottotipi. Linfomi e tumori mesenchimali possono anch'essi svilupparsi all'interno dello stomaco. La diagnosi solitamente viene fatta tramite una biopsia realizzata durante l'endoscopia. A ciò seguono indagini di imaging biomedico per determinare se la malattia si è diffusa in altre parti del corpo.[2] In Giappone e Corea del Sud, due paesi che presentano alti tassi di malattia, vengono adottate campagne di screening per la patologia.[5]
I trattamenti possono includere il ricorso alla chirurgia, alla chemioterapia, la radioterapia e la terapia mirata.[2] Se il tumore si trova in uno stadio avanzato, si può fare ricorso alle cure palliative.[5] La prognosi è spesso infausta, con un tasso di sopravvivenza a 5 anni inferiore al 10% a livello globale. Ciò è in gran parte dovuto al fatto che nelle fasi iniziali si presenta con nessuno o scarsi sintomi e la diagnosi avviene quindi tardivamente.[6]
Il tumore allo stomaco si riscontra più comunemente in Asia orientale e in Europa orientale e due volte più frequentemente nei soggetti maschi rispetto alle femmine.[5]
Epidemiologia modifica
nessun dato
<3.5
3.5–8
8–12.5
12.5–17
17–21.5
21.5–26
26–30.5
30.5–35
35–40
40–45
45–50
>50
Il tumore dello stomaco è la quarta neoplasia più comune in tutto il mondo con 930.000 casi diagnosticati nel 2002.[8] Si riscontra più frequentemente negli uomini e nei paesi in via di sviluppo.[8][9] Nel 2012, ha rappresentato l'8,5% dei casi di tumore negli uomini diventando il quarto tumore più comune del sesso maschile.[10] Nel 2012 il numero di decessi sono stati 700.000, un dato leggermente diminuito rispetto ai 774.000 registrati nel 1990: è il terzo tumore più letale dopo il tumore del polmone e il tumore del fegato.[11][12]
Meno del 5% dei casi si verifica in persone sotto i 40 anni di età, con l'81,1% di tale 5% nella fascia di età tra i 30 e i 39 e il restante 18,9% tra i 20 e i 29.[13]
Nel 2011, il tumore allo stomaco ha rappresentato il 0,64% dei decessi (13.230 casi) negli Stati Uniti[14] mentre in Cina è stata la causa del 3,99% (354.829 casi).[15] Il tasso di mortalità più alto si registra nelle Maldive dove rappresenta il 8,92% di tutte le morti.[16] Nel Regno Unito è la quindicesima neoplasia più comune (circa 7.100 diagnosi nel 2011) ed è la decima causa più comune di morte per tumore (circa 4.800 decessi nel 2012).[17]
L'incidenza e la mortalità del tumore allo stomaco variano notevolmente in Africa. Il sistema GLOBOCAN è attualmente il metodo più usato per confrontare i valori tra i paesi ma nel contiinente africano i risultati risultano differire enormemente tra i vari stati, forse a causa della mancanza di accesso universale ad un sistema di registrazione.[18] Sono stati registrati tassi di 0,3 casi su 100.000 abitanti in Mali a 20,3 casi su 100.000 in Botswana.[18] in Uganda l'incidenza di tumore allo stomaco è aumentato dal 1960 da 0,8 a 5,6 casi su 100.000.[18] Una sospetta causa di questa notevole variazione all'interno dell'Africa e tra gli altri paesi è dovuto ai diversi ceppi di batteri Helicobacter pylori; tuttavia ciò non è stato ancora provato.[19]
Eziologia modifica
Il tumore allo stomaco è una patologia multifattoriale.[20] L'infezione da Helicobacter pylori è un fattore di rischio riconosciuto nel 65%-80% dei casi, ma solo nel 2% di tali infezioni porta a sviluppare la neoplasia.[21][22] Il meccanismo con cui l'H. pylori induce il cancro allo stomaco coinvolge l'infiammazione cronica o l'azione dei fattori di virulenza, come il CagA.[23]
Il tabagismo aumenta significativamente il rischio di sviluppare il tumore allo stomaco: da un aumento del 40% per i fumatori correnti ad un aumento dell'82% per i forti fumatori. I tumori gastrici causati dal fumo si verificano soprattutto nella parte superiore dello stomaco e nell'esofago distale.[24][25][26] Alcuni studi mostrano un aumento del rischio dovuto al consumo di alcol.[22][27]
Non è stato dimostrato che l'adozione di una particolare dieta possa essere una causa, ma alcuni alimenti, tra cui cibi affumicati[28], cibi salati e ricchi di sale, carne rossa, carni lavorate e verdure sott'olio[22], sono stati correlati ad un rischio più elevato di incorrere in tale patologia. Nitrati e nitriti presenti nei salumi possono essere convertiti da alcuni batteri, tra cui l'H. pylori, in composti che sono stati dimostrati essere responsabili, negli animali, dell'insorgenza di un tumore allo stomaco. D'altra parte, la frutta fresca e la verdura, gli agrumi e l'assunzione di antiossidanti sono associati con una diminuzione del rischio di cancro.[22][24] Seguire una dieta mediterranea può portare un beneficio.[29]
Esiste una correlazione tra carenza di iodio e il tumore allo stomaco.[30][31][32]
L'incidenza di questa neoplasia mostra una predominanza maschile: fino al doppio rispetto al sesso femminile. Sembra che gli estrogeni possano svolgere un ruolo protettivo.[33][34][35]
Circa il 10% dei casi mostra una componente genetica.[36]
Le persone possono avere alcuni fattori di rischio, fisici o genetici, che possono alterare la loro suscettibilità al tumore dello stomaco. L'obesità è uno di questi fattori di rischio fisico che aumenta la probabilità di sviluppare adenocarcinoma gastrico in seguito all'instaurarsi della malattia da reflusso gastroesofageo.[37] Il meccanismo esatto attraverso il quale l'obesità provoca il reflusso non è completamente noto. Gli studi ipotizzano che l'aumento dei grassi alimentari e del tessuto adiposo in eccesso, con conseguente aumento della pressione sullo stomaco e sullo sfintere esofageo inferiore, possa essere una spiegazione, ma vi sono (al 2014) ancora dati statisticamente significativi.[38] Tuttavia, il rischio di adenocarcinoma gastrico con presenza di reflusso gastroesofageo è stato riscontrato con una frequenza doppia nelle persone obese.[37]
Un difetto genetico del gene CDH1 è anch'esso un fattore di rischio. Questo gene, che codifica per le E-caderine, si trova sul cromosoma 16.[39] Quando va in corso a una particolare mutazione si sviluppa il tumore allo stomaco attraverso un meccanismo che al 2014 non è stato ancora del tutto chiarito.[39] Questa mutazione è considerata autosomica dominante.[39] La diagnosi di ereditarietà al tumore allo stomaco solitamente avviene quando si riscontrano almeno due casi in membri della stessa famiglia, come ad esempio un genitore o un nonno, con almeno uno che avviene prima dei 50 anni.[39] La diagnosi può essere fatta anche se vi sono almeno tre casi in famiglia senza dover considerare l'età.[39]
Altri fattori associati ad un aumento del rischio sono l'AIDS[22], il diabete[40], l'anemia perniciosa[27], la gastrite cronica atrofica[41], la malattia di Ménétrier[42], l'ulcera peptica e la metaplasia intestinale.[43]
Iodio nella mucosa gastrica modifica
Lo iodio pesa per il 65% del peso molecolare della tiroxina (T4) e per il 59% della triiodotironina (T3). 15–20 mg di iodio sono concentrati nella tiroide e nei relativi ormoni, mentre il 70% dello iodio presente nel corpo umano è distribuito in altri tessuti ed in particolare nella mucosa dello stomaco e nelle ghiandole salivari. Lo iodio entra direttamente nelle cellule di questi tessuti grazie ad un iodio-trasportatore (NIS).[44]
Alcuni ricercatori hanno trovato una correlazione epidemiologica e biochimica tra carenza di iodio, gozzo e cancro gastrico.[31][32][45][46]
Una diminuzione dell'incidenza del tasso di mortalità da cancro allo stomaco dopo l'attuazione dei iodio-profilassi efficace è stata anche riportata da ricercatori in Polonia.[47]
Classificazione modifica
Esistono varie tipi di neoplasie allo stomaco, sia benigne (costituiti da cellule che mantengono in parte le loro caratteristiche morfologiche e funzionali) che maligni:
| Neoplasie benigne | Neoplasie maligne |
|---|---|
I tumori benigni dello stomaco più comuni sono:
|
Tra i tumori maligni vi sono:
|
Forma del tutto particolare di neoplasia gastrica è il carcinoma precoce dello stomaco (Early gastric cancer).[48]
Clinica modifica
Segni e sintomi modifica
Il tumore dello stomaco, nelle sue fasi iniziali, appare spesso o asintomatico (cioè senza sintomi evidenti) o può causare solo sintomi aspecifici (sintomi che sono riconducibili non solo al tumore ma anche ad altri disturbi correlati o indipendenti). Con il trascorrere del tempo iniziano a manifestarsi alcuni sintomi e, a questo punto, il tumore spesso ha raggiunto uno stadio avanzato e può aver generato metastasi (diffusione in altre parti del corpo) e ciò rappresenta uno dei motivi della sua prognosi raramente positiva.[49]
Tumori allo stomaco precoci possono essere confusi con l'indigestione o con una sensazione di bruciore (pirosi). Tuttavia meno di 1 caso su 50 di endoscopie dovute ad indigestione presentano come referto un tumore.[50] Si può presentare intolleranza alla carne (sarcofobia) e scarsità di appetito.
Tumori gastrici che si sono espansi notevolmente e hanno invaso il tessuto normale possono causare debolezza, stanchezza, gonfiore di stomaco dopo i pasti, dolore addominale nella parte superiore, nausea e vomito occasionale, diarrea o costipazione. Un'ulteriore espansione può causare una perdita di peso o sangue nel vomito o nelle feci, queste ultime appaiono con colorazione nera (melena) e talvolta ciò porta all'anemia. La presenza di disfagia suggerisce un tumore nel cardias o l'estensione del tumore gastrico all'esofago.
Si noti che questi sintomi possono essere propri anche di altre patologie, come un'infezione virale allo stomaco, un'ulcera gastrica o sprue tropicale.
Un raro sintomo di un tumore gastrico in stato avanzato può essere gli occhi di colore giallo, segno dell'accumulo di bilirubina nel fegato e negli altri organi (ittero), accumulo che si verifica nella sindrome di Gilbert.[51]
Diagnosi modifica
Per trovare la causa dei sintomi, oltre ad analizzare la storia clinica del paziente ed eseguire un esame fisico, possono essere prescritti uno o tutti i seguenti esami:
- Gastroscopia, è la metodologia diagnostica di scelta. Essa consiste nell'inserimento di una telecamera in fibra ottica nello stomaco al fine di visualizzare l'organo.[27]
- Serie di radiografie del tratto digestivo superiore, utilizzando del bario assunto per os.
- La tomografia computerizzata dell'addome può rivelare un tumore gastrico ma risulta più utile per determinare l'eventuale invasione nei tessuti adiacenti o la presenza di metastasi ai linfonodi locali.[52]
Nel 2013, studiosi cinesi e israeliani hanno riportato uno studio pilota di successo su un test del respiro (come un etilometro) al fine di diagnosticare il tumore allo stomaco analizzando i prodotti chimici esalati, senza che vi sia la necessità di una, più invadente, endoscopia. A partire dal 2013 è in corso uno studio clinico su larga scala.[53]
Una volta che viene individuato un tessuto anormale durante la gastroscopia, viene effettuata una biopsia di esso e quindi effettuato un esame istologico per verificare la presenza di cellule cancerose; questo è l'unico modo sicuro per confermare la diagnosi.[27]
Stadiazione modifica
Se nel campione di tessuto vengono trovate delle cellule tumorali, il passo successivo è quello di effettuare una stadiazione e scoprire l'estensione della malattia. Vari test sono disponibili per determinare se il tumore si sia diffuso e, in caso affermativo, quali parti dell'organismo sono interessate. Poiché il tumore dello stomaco può diffondersi più facilmente al fegato, al pancreas, ai polmoni e ad altri organi vicini, può essere richiesta una tomografia computerizzata, una scansione PET[54], un'ecografia endoscopica o altri esami per verificare queste aree. Gli esami del sangue per i marcatori tumorali, come ad esempio l'antigene carcino-embrionale (CEA) e l'antigene carboidratico (CA 19-9), possono essere utili.
La stadiazione, tuttavia, non può essere completa che dopo l'intervento chirurgico. Il chirurgo rimuove i linfonodi vicini e alcuni campioni di tessuto da altre zone nell'addome perché possa essere fatto un esame da un patologo.
Gli stadi clinici del tumore allo stomaco sono[55][56]:
- Stadio 0: neoplasia limitata al rivestimento interno dello stomaco. Curabile con resezione endoscopica della mucosa quando esso viene trovato precocemente (durante lo screening di routine); altrimenti gastrectomia e linfoadenectomia senza bisogno di chemioterapia o radioterapia.
- Stadio I: penetrazione della neoplasia al secondo o terzo strato dello stomaco (stadio 1A) o al secondo strato e coinvolgimento linfonodi regionali (stadio 1B). Lo stadio 1A è trattato con la chirurgia, compresa la rimozione dell'omento. Lo stadio 1B può essere trattato con la chemioterapia (5-fluorouracile) e la radioterapia.
- Stadio II: penetrazione al secondo strato e ai linfonodi più distanti o penetrazione al terzo strato e solo linfonodi locali o tutti e quattro gli strati, ma nessun coinvolgimento linfonodale. Trattamento identico allo stadio I, a volte con l'aggiunta di chemioterapia neoadiuvante.
- Stadio III: penetrazione al terzo strato e metastatizzazione ai linfonodi più distanti o penetrazione al quarto strato e propagazione ai tessuti circostanti e ai linfonodi locali. Trattamento simile allo stadio II; una cura è ancora possibile in alcuni casi.
- Stadio IV: il tumore si è diffuso ai tessuti circostanti e ai linfonodi più distanti, o ha metastatizzato ad altri organi. Una possibilità di cura è raramente possibile a questo stadio. Alcune tecniche per prolungare la vita o migliorare i sintomi sono utilizzabili, tra cui il trattamento laser, la chirurgia e/o il posizionamento di uno stent per mantenere pervio l'apparato digerente e la chemioterapia farmacologica con il 5-fluorouracile, cisplatino, epirubicina, etoposide, docetaxel, oxaliplatino, capecitabina o irinotecano.
Le metastasi si sviluppano preferenzialmente a carico di fegato, linfoghiandole sovraclaveari sinistre, ovaio e peritoneo.
Spesso viene utilizzato anche la classificazione TNM (T dimensione del tumore, N coinvolgimento linfonodale, M presenza di metastasi)[57]
| TX | Tumore primitivo non può essere determinato. |
| T0 | Non vi sono prove di un tumore primario |
| Tis | Carcinoma in situ: tumore intraepiteliale senza invasione della lamina propria |
| T1 | Infiltrazione della lamina propria o sottomucosa |
| T1a | Infiltrazione della lamina propria o della tonaca muscolare |
| T1b | Infiltrazione della sottomucosa |
| T2 | Infiltrazione della tonaca muscolare |
| T3 | Infiltrazione al tessuto connettivo sottosieroso senza infiltrazione dell'invasione del peritoneo viscerale o delle strutture adiacenti. T3 include anche i tumori che si diffondono raggiungendo il grande omento, senza penetrazione del peritoneo viscerale che circonda queste strutture. |
| T4 | Infiltrazione degli organi adiacenti (milza, colon, fegato, diaframma, pancreas, ghiandola surrenale, rene, intestino tenue o retroperitoneo) |
| T4a | Infiltrazione della sierosa (peritoneo viscerale) |
| T4b | Infiltrazione degli organi adiacenti (milza, colon trasverso, fegato, diaframma, del pancreas, della parete addominale, surrene, rene, intestino tenue o retroperitoneo) |
| NX | La propagazione di linfonodi locali non può essere valutata |
| N0 | Linfonodi locali non interessati |
| N1 | Metastasi in uno o due linfonodi locali |
| N2 | Metastasi in 3-6 linfonodi locali |
| N3 | Metastasi in sette o più linfonodi locali |
| M0 | Nessuna metastasi a distanza rilevata |
| M1 | Presenza di metastasi a distanza |
Trattamento modifica
Il tumore dello stomaco è difficile da curare a meno che non si trovi in una fase iniziale, cioè prima che abbia iniziato a diffondersi. Purtroppo, poiché il tumore allo stomaco precoce provoca pochi sintomi, di solito la malattia si trova in uno stadio avanzato al momento della diagnosi.[58] Il trattamento può includere la chirurgia, la chemioterapia[59] e/o la radioterapia.[60] Nuovi approcci terapeutici, quali come terapia biologica e miglioramenti nell'utilizzo dei metodi attuali, sono in fase di studio clinico.[61]
Trattamento chirurgico modifica
La chirurgia rimane l'unica terapia curativa per il tumore dello stomaco.[6] Tra le diverse tecniche chirurgiche, la dissezione endoscopica della sottomucosa è un trattamento per il tumore gastrico precoce (una neoplasia che coinvolge solo la mucosa) sperimentato inizialmente in Giappone.[6] In questa procedura, il tumore, insieme al rivestimento interno dello stomaco (mucosa), viene rimosso dalla parete di esso utilizzando un filo elettrico posto sull'endoscopio. Il vantaggio è che è un'operazione molto meno invasiva rispetto alla rimozione dello stomaco.[6] La dissezione sottomucosa endoscopica è una tecnica simile, sempre di origine giapponese, utilizzata per resecare una vasta area della mucosa in un unico pezzo.[6] Se l'esame patologico del campione di tessuto resecato mostra una resezione incompleta o un'invasione profonda del tumore, il paziente ha bisogno di una resezione totale dello stomaco.[6]
Per coloro che presentano diffusione metastatica al momento della diagnosi, può essere proposta la chirurgia palliativa, tuttavia i suoi benefici sono oggetto di controversie in quanto si devono considerare i ritardi nell'assunzione della chemioterapia e dei rischi intrinseci che questa scelta comporta.[6][62]
Chemioterapia modifica
L'utilizzo della chemioterapia per curare il cancro allo stomaco non è uno standard di cura. Purtroppo, questo tipo di tumore non è particolarmente sensibile a questi farmaci e la chemioterapia, se utilizzata, serve solitamente solo per ridurre le sue dimensioni, alleviare i sintomi della malattia e aumentare il tempo di sopravvivenza. Alcuni farmaci utilizzati nel trattamento includono: 5-FU (fluorouracile) o il suo analogo capecitabina, BCNU (carmustina), metil-CCNU (Semustine) e doxorubicina (Adriamicina) nonché mitomicina C e più recentemente cisplatino e docetaxel, spesso utilizzando questi farmaci in varie combinazioni. I risultati relativi di questi farmaci, da soli o in combinazione, non sono tuttavia chiari. [65] I ricercatori clinici hanno valutato i benefici della somministrazione di chemioterapia prima dell'intervento chirurgico al fine di ridurre il tumore o come terapia adiuvante dopo l'intervento chirurgico per distruggere le cellule tumorali restanti.[6] Recentemente, un trattamento mirato, chiamato trastuzumab, è diventato disponibile per l'uso combinato con la chemioterapia per il trattamento di coloro con sovraespressione del gene HER2 nelle cellule tumorali.[6]
Radioterapia modifica
La radioterapia può essere utilizzata per trattare il tumore allo stomaco, spesso come terapia adiuvante alla chemioterapia e/o alla chirurgia.[6]
Prognosi modifica
La prognosi del cancro dello stomaco è spesso infausta per via delle frequenti metastasi riscontrabili al momento della scoperta e per la generale età avanzata di chi ne soffre (l'età media alla diagnosi è tra i 70 e i 75 anni).[63] Il tasso di sopravvivenza a 5 anni per il tumore dello stomaco è ritenuto essere inferiore al 10%.[6]
Note modifica
- ^ Stomach (Gastric) Cancer, su NCI. URL consultato il 1º luglio 2014.
- ^ a b c Gastric Cancer Treatment (PDQ®), su NCI, 17 aprile 2014. URL consultato il 1º luglio 2014.
- ^ Raymond W. Ruddon, Cancer biology, 4th, Oxford, Oxford University Press, 2007, p. 223, ISBN 978-0-19-517543-1.
- ^ edited by Fiona Sim e Martin McKee, Issues in public health, 2nd, Maidenhead, Open University Press, 2011, p. 74, ISBN 978-0-335-24422-5.
- ^ a b c d World Cancer Report 2014, World Health Organization, 2014, pp. Chapter 5.4, ISBN 92-832-0429-8.
- ^ a b c d e f g h i j k M Orditura, Galizia, G; Sforza, V; Gambardella, V; Fabozzi, A; Laterza, MM; Andreozzi, F; Ventriglia, J; Savastano, B; Mabilia, A; Lieto, E; Ciardiello, F; De Vita, F, Treatment of gastric cancer. (PDF), in World Journal of Gastroenterology, vol. 20, n. 7, febbraio 2014, pp. 1635-49, DOI:10.3748/wjg.v20.i7.1635, PMC 3930964, PMID 24587643 (archiviato dall'url originale il 7 aprile 2014).
- ^ WHO Disease and injury country estimates, su World Health Organization, 2009. URL consultato l'11 novembre 2009.
- ^ a b Parkin DM, Bray F, Ferlay J, Pisani P, Bray, Ferlay e Pisani, Global Cancer Statistics, 2002, in CA: A Cancer Journal for Clinicians, vol. 55, n. 2, 2005, pp. 74-108, DOI:10.3322/canjclin.55.2.74, PMID 15761078.
- ^ Are the number of cancer cases increasing or decreasing in the world?, su WHO Online Q&A, WHO, 1º aprile 2008. URL consultato l'11 maggio 2009.
- ^ World Cancer Report 2014, International Agency for Research on Cancer, World Health Organization, 2014, ISBN 978-92-832-0432-9.
- ^ R Lozano, M Naghavi, K Foreman, S Lim, K Shibuya, V Aboyans, J Abraham, T Adair, R Aggarwal, SY Ahn, M Alvarado, HR Anderson, LM Anderson, KG Andrews, C Atkinson, LM Baddour, S Barker-Collo, DH Bartels, ML Bell, EJ Benjamin, D Bennett, K Bhalla, B Bikbov, A Bin Abdulhak, G Birbeck, F Blyth, I Bolliger, S Boufous, C Bucello e M Burch, Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010, in Lancet, vol. 380, n. 9859, 15 dicembre 2012, pp. 2095-128, DOI:10.1016/S0140-6736(12)61728-0, PMID 23245604.
- ^ PRESS RELEASE N° 224 Global battle against cancer won’t be won with treatment alone Effective prevention measures urgently needed to prevent cancer crisis (PDF), su World Health Organization, 3 febbraio 2014. URL consultato il 14 marzo 2014.
- ^ Gastric Cancer in Young Adults, in Revista Brasileira de Cancerologia, vol. 46, n. 3, Jul 2000.
- ^ Health profile: United States, su worldlifeexpectancy.com, Le Duc Media. URL consultato il 13 marzo 2014.
- ^ Health profile: China, su worldlifeexpectancy.com, Le Duc Media. URL consultato il 13 marzo 2014.
- ^ Health profile: Maldives, su worldlifeexpectancy.com, Le Duc Media. URL consultato il 13 marzo 2014.
- ^ Stomach cancer statistics, su Cancer Research UK. URL consultato il 28 ottobre 2014.
- ^ a b c Asombang Akwi W, Rahman Rubayat, Ibdah Jamal A, Gastric cancer in Africa: Current management and outcomes, in World Journal of Gastroenterology, vol. 20, 2014, pp. 3875-79, DOI:10.3748/wjg.v20.i14.3875.
- ^ Louw J. A., Kidd M. S. G., Kummer A. F., Taylor K., Kotze U., and Hanslo D., The relationship between helicobacter pylori infection, the virulence genotypes of the infecting strain and gastric cancer in the African setting, in Helicobacter, vol. 6, n. 4, novembre 2001, pp. 268-73.
- ^ Lee YY, Derakhshan MH, Environmental and lifestyle risk factors of gastric cancer, in Arch Iran Med., vol. 16, n. 6, Jun 2013, pp. 358-65, PMID 23725070.
- ^ Proceedings of the fourth Global Vaccine Research Forum (PDF), su Initiative for Vaccine Research team of the Department of Immunization, Vaccines and Biologicals, WHO, aprile 2004. URL consultato l'11 maggio 2009.«Epidemiology of Helicobacter pylori and gastric cancer…»
- ^ a b c d e González CA, Sala N, Rokkas T, Sala e Rokkas, Gastric cancer: epidemiologic aspects, in Helicobacter, vol. 18, Supplement 1, 2013, pp. 34-38, DOI:10.1111/hel.12082, PMID 24011243.
- ^ Hatakeyama, M. & Higashi, H e Higashi, Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis, in Cancer Science, vol. 96, n. 12, 2005, pp. 835-843, DOI:10.1111/j.1349-7006.2005.00130.x, PMID 16367902.
- ^ a b What Are The Risk Factors For Stomach Cancer(Website), su cancer.org, American Cancer Society. URL consultato il 31 marzo 2010 (archiviato dall'url originale il 6 luglio 2010).
- ^ Nomura A, Grove JS, Stemmermann GN, Severson RK, Grove, Stemmermann e Severson, Cigarette smoking and stomach cancer, in Cancer Research, vol. 50, n. 21, 1990, p. 7084, PMID 2208177.
- ^ Trédaniel J, Boffetta P, Buiatti E, Saracci R, Hirsch A, Boffetta, Buiatti, Saracci e Hirsch, <565::AID-IJC3>3.0.CO;2-O Tobacco smoking and gastric cancer: Review and meta-analysis, in International Journal of Cancer, vol. 72, n. 4, agosto 1997, pp. 565-73, DOI:10.1002/(SICI)1097-0215(19970807)72:4<565::AID-IJC3>3.0.CO;2-O, PMID 9259392.
- ^ a b c d Thrumurthy SG, Chaudry MA, Hochhauser D, Ferrier K, Mughal M, Chaudry, Hochhauser e Mughal, The diagnosis and management of gastric cancer, in British Medical Journal, vol. 347, n. 16, 2013, pp. 1695-6, DOI:10.1136/bmj.f6367, PMID 24291271.
- ^ Jakszyn P, González CA e Gonzalez, Nitrosamine and related food intake and gastric and oesophageal cancer risk: A systematic review of the epidemiological evidence (PDF), in World J Gastroenterol, vol. 12, n. 27, 2006, pp. 4296-4303, PMC 4087738, PMID 16865769 (archiviato dall'url originale l'11 marzo 2014).
- ^ Buckland G, Agudo A, Luján L, et al., Adherence to a Mediterranean diet and risk of gastric adenocarcinoma within the European Prospective Investigation into Cancer and Nutrition (EPIC) cohort study, in Am. J. Clin. Nutr., vol. 91, n. 2, febbraio 2010, pp. 381-90, DOI:10.3945/ajcn.2009.28209, PMID 20007304.
- ^ Venturi, S, Donati, F.M.; Venturi, A.; Venturi, M.;, Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach.= Adv Clin Path., vol. 4, n. 4, 2000, pp. 11-17, PMC 2452979, PMID 10936894.
- ^ a b M. Josefsson e E. Ekblad, 22. Sodium Iodide Symporter (NIS) in Gastric Mucosa: Gastric Iodide Secretion, in Victor R. Preedy, Gerard N. Burrow e Ronald Watson (a cura di), Comprehensive Handbook of Iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects, Elsevier, 2009, pp. 215-220, ISBN 978-0-12-374135-6.
- ^ a b Venturi, Sebastiano, Evolutionary Significance of Iodine, in Current Chemical Biology-, vol. 5, n. 3, 2011, pp. 155-162, DOI:10.2174/187231311796765012, ISSN 1872-3136.
- ^ Evangelos Chandanos, Estrogen in the development of esophageal and gastric adenocarcinoma (PDF) (Doctoral thesis), Karolinska Institutet, dicembre 2007, ISBN 978-91-7357-370-2.
- ^ Chandanos E, Lagergren J. Oestrogen and the enigmatic male predominance of gastric cancer. Eur J Cancer. 2008 Nov;44(16):2397-403.
- ^ Qin J, Liu M, Ding Q, et al., The direct effect of estrogen on cell viability and apoptosis in human gastric cancer cells, in Mol. Cell. Biochem., vol. 395, n. 1-2, ottobre 2014, pp. 99-107, DOI:10.1007/s11010-014-2115-2, PMID 24934239.
- ^ Lee H-J, Yang H-K, Ahn Y-O, Yang e Ahn, Gastric cancer in Korea, in Gastric Cancer, vol. 5, n. 3, 2002, pp. 177-82, DOI:10.1007/s101200200031, PMID 12378346.
- ^ a b Crew K, Neugut A, Epidemiology of gastric cancer, in World Journal of Gastroenterology, vol. 12, n. 3, gennaio 2006, pp. 354-62.
- ^ Hampel Howard, Abraham Neena S., and El-Serag Hashem B., Meta-Analysis: obesity and the risk for gastroesophageal reflux disease and its complications, in Annal of Internal Medicine, vol. 143, n. 3, agosto 2005, pp. 199-211.
- ^ a b c d e Hereditary Diffuse Cancer, su No Stomach for Cancer. URL consultato il 21 ottobre 2014.
- ^ Tseng C-H, Tseng F-H e Tseng, Diabetes and gastric cancer: The potential links, in World J Gastroenterol, vol. 20, n. 7, 2014, pp. 1701-11, DOI:10.3748/wjg.v20.i7.1701, PMC 3930970, PMID 24587649.
- ^ Crosby DA, Donohoe CL, Fitzgerald L, Muldoon C, Hayes B, O’Toole D, Reynolds JV, Donohoe, Fitzgerald, Muldoon, Hayes, O'Toole e Reynolds, Gastric Neuroendocrine Tumours, in Digestive Surgery, vol. 29, n. 4, 2004, pp. 331-348, DOI:10.1159/000342988, PMID 23075625.
- ^ Kim J, Cheong JH, Chen J, Hyung WJ, Choi SH, Noh SH, Cheong, Chen, Hyung, Choi e Noh, Menetrier's Disease in Korea: Report of Two Cases and Review of Cases in a Gastric Cancer Prevalent Region (PDF), in Yonsei Medical Journal, vol. 45, n. 3, 2004, pp. 555-560, PMID 15227748.
- ^ Tsukamoto T, Mizoshita T, Tatematsu M, Mizoshita e Tatematsu, Gastric-and-intestinal mixed-type intestinal metaplasia: aberrant expression of transcription factors and stem cell intestinalization, in Gastric cancer, vol. 9, n. 3, 2006, pp. 156-166, DOI:10.1007/s10120-006-0375-6, PMID 16952033.
- ^ M. Paroder-Belenitsky, MJ. Maestas; O. Dohán; JP. Nicola; A. Reyna-Neyra; A. Follenzi; E. Dadachova; S. Eskandari; LM. Amzel; N. Carrasco, Mechanism of anion selectivity and stoichiometry of the Na+/I- symporter (NIS)., in Proc Natl Acad Sci U S A, vol. 108, n. 44, novembre 2011, pp. 17933-8, DOI:10.1073/pnas.1108278108, PMID 22011571.
- ^ Abnet CC, Fan JH, Kamangar F, Sun XD, Taylor PR, Ren JS, Mark SD, Zhao P, Fraumeni JF Jr, Qiao YL, Dawsey SM, Self-reported goiter is associated with a significantly increased risk of gastric noncardia adenocarcinoma in a large population-based Chinese cohort, in International Journal of Cancer, vol. 119, n. 6, 2006, pp. 1508-1510, DOI:10.1002/ijc.21993, PMID 16642482.
- ^ R. Behrouzian e N. Aghdami, Urinary iodine/creatinine ratio in patients with stomach cancer in Urmia, Islamic Republic of Iran, in East Mediterr Health J., vol. 10, n. 6, 2004, pp. 921-924, PMID 16335780.
- ^ Golkowski F, Szybinski Z, Rachtan J, Sokolowski A, Buziak-Bereza M, Trofimiuk M, Hubalewska-Dydejczyk A, Przybylik-Mazurek E, Huszno B., Iodine prophylaxis—the protective factor against stomach cancer in iodine deficient areas, in Eur J Nutr., vol. 46, n. 5, 2007, pp. 251-6, DOI:10.1007/s00394-007-0657-8, PMID 17497074.
- ^ Carter KJ, Schaffer HA, Ritchie WP, Early gastric cancer [collegamento interrotto], in Ann. Surg., vol. 199, n. 5, maggio 1984, pp. 604-9, PMC 1353502, PMID 6721609.
- ^ Statistics and outlook for stomach cancer, su cancerresearchuk.org, Cancer Research UK. URL consultato il 19 febbraio 2014 (archiviato dall'url originale il 5 gennaio 2014).
- ^ Guidance on Commissioning Cancer Services Improving Outcomes in Upper Gastro-intestinal Cancers (PDF), su dh.gov.uk, NHS, Jan 2001 (archiviato dall'url originale il 13 ottobre 2012).
- ^ Tumore allo stomaco, il segnale del cancro (in stato avanzato) nell'occhio, su ilgazzettino.it, 22 dicembre 2022, DOI:10.7759/cureus.32478.
- ^ V Virmani, A Khandelwal, V Sethi, M Fraser-Hill, N Fasih e A Kielar, Neoplastic stomach lesions and their mimickers: Spectrum of imaging manifestations, in Cancer imaging : the official publication of the International Cancer Imaging Society, vol. 12, 2012, pp. 269-78, DOI:10.1102/1470-7330.2012.0031, PMC 3458788, PMID 22935192.
- ^ Xu ZQ, Broza YY, Ionsecu R e and others, A nanomaterial-based breath test for distinguishing gastric cancer from benign gastric conditions, in Br. J. Cancer, vol. 108, n. 4, marzo 2013, pp. 941-50, DOI:10.1038/bjc.2013.44, PMC 3590679, PMID 23462808.
- ^ Lim JS, Yun MJ, Kim MJ, Hyung WJ, Park MS, Choi JY, Kim TS, Lee JD, Noh SH, Kim KW, Yun, Kim, Hyung, Park, Choi, Kim, Lee, Noh e Kim, CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy, in Radiographics, vol. 26, n. 1, 2006, pp. 143-156, DOI:10.1148/rg.261055078, PMID 16418249.
- ^ Detailed Guide: Stomach Cancer Treatment Choices by Type and Stage of Stomach Cancer, su cancer.org, American Cancer Society, 3 novembre 2009 (archiviato dall'url originale l'8 ottobre 2009).
- ^ Guy Slowik, What Are The Stages Of Stomach Cancer?, su ehealthmd.com, ottobre 2009. URL consultato il 23 dicembre 2014 (archiviato dall'url originale il 2 gennaio 2010).
- ^ Detailed Guide: Stomach Cancer: How Is Stomach Cancer Staged?, su cancer.org, American Cancer Society. URL consultato il 23 dicembre 2014 (archiviato dall'url originale il 25 marzo 2008).
- ^ Roopma Wadhwa, Takashi Taketa, Kazuki Sudo, Mariela A. Blum, Jaffer A. Ajani, Taketa, Sudo, Blum e Ajani, Modern Oncological Approaches to Gastric Adenocarcinoma, in Gastroenterology Clinics of North America, vol. 42, n. 2, 2013, pp. 359-369, DOI:10.1016/j.gtc.2013.01.011, PMID 23639645.
- ^ Ke Chen, Xiao-Wu Xu, Ren-Chao Zhang, Yu Pan, Di Wu, Yi-Ping Mou, Xu, Zhang, Pan, Wu e Mou, Systematic review and meta-analysis of laparoscopy-assisted and open total gastrectomy for gastric cancer, in World J Gastroenterol, vol. 19, n. 32, 2013, pp. 5365-76, DOI:10.3748/wjg.v19.i32.5365, PMC 3752573, PMID 23983442.
- ^ Jennifer L. Pretz, Jennifer Y. Wo, Harvey J. Mamon, Lisa A. Kachnic, Theodore S. Hong, Wo, Mamon, Kachnic e Hong, Chemoradiation Therapy: Localized Esophageal, Gastric, and Pancreatic Cancer, in Surgical oncology clinics of North America, vol. 22, n. 3, 2011, pp. 511-524, DOI:10.1016/j.soc.2013.02.005, PMID 23622077.
- ^ Judith Meza-Junco, Heather-Jane Au, Michael B Sawyer, Au e Sawyer, Critical appraisal of trastuzumab in treatment of advanced stomach cancer, in Cancer Management and Research, vol. 2011, n. 3, 2011, pp. 57-64, DOI:10.2147/CMAR.S12698, PMC 3085240, PMID 21556317.
- ^ J Sun, Song, Y, Wang, Z, Chen, X, Gao, P, Xu, Y, Zhou, B e Xu, H, Clinical significance of palliative gastrectomy on the survival of patients with incurable advanced gastric cancer: a systematic review and meta-analysis. (PDF), in BMC cancer, vol. 13, dicembre 2013, p. 577, DOI:10.1186/1471-2407-13-577, PMID 24304886.
- ^ Cabebe, EC; Mehta, VK; Fisher, G, Jr, Gastric Cancer, su Talavera, F; Movsas, M; McKenna, R; Harris, JE (a cura di), Medscape Reference, WebMD, 21 gennaio 2014. URL consultato il 4 aprile 2014.
Voci correlate modifica
Altri progetti modifica
- Wikimedia Commons contiene immagini o altri file su tumore dello stomaco
Collegamenti esterni modifica
- Tumore allo stomaco da AIRC – Associazione Italiana Ricerca sul cancro, su airc.it.
- Cancro dello stomaco - Informazioni cliniche, fattori di rischio, diagnosi, terapie, su centroesofagopadova.org
| Controllo di autorità | LCCN (EN) sh85128258 · GND (DE) 4036951-1 · J9U (EN, HE) 987007536297505171 · NDL (EN, JA) 00563908 |
|---|