Samario
Il samario è l'elemento chimico di numero atomico 62 e il suo simbolo è Sm.
| Samario | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | samario, Sm, 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | lantanidi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | —, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 7 353 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 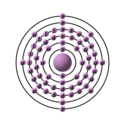 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 7F0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 150,36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 198±8 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Xe]6s24f6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 18, 24, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 3 (debolmente basico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | romboedrica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 1 345 K (1 072 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 2 067 K (1 794 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 19,98×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 165 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 8,62 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 563 Pa a 1 345 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 2130 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,17 (scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 200 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 9,56×105/m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 13,3 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 544,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 070 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 260 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 3 990 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Caratteristiche modifica
Il samario è un metallo dei lantanidi dall'aspetto argenteo, abbastanza stabile all'aria a temperature inferiori a 150 °C; sopra questo limite si incendia spontaneamente.
Esiste in tre forme cristalline differenti in funzione della temperatura; le temperature di conversione tra di esse sono 734 °C e 922 °C.
Applicazioni modifica
Tra gli usi del samario rientrano:
- la produzione di lampade ad arco per la cinematografia, insieme ad altri elementi delle terre rare
- il drogaggio dei cristalli di CaF2 per la realizzazione di laser e maser
- la realizzazione di assorbitori di neutroni nei reattori nucleari
- alcune leghe speciali
- la produzione di magneti permanenti a elevata resistenza alla smagnetizzazione, i magneti samario-cobalto SmCo5
- produzione di vetri capaci di assorbire la luce infrarossa mediante l'addizione di ossido di samario
- la disidratazione e la deidrogenazione dell'etanolo, reazioni per cui l'ossido di samario è un catalizzatore
- la medicina nucleare: l'isotopo 153 è utilizzato in medicina per la terapia delle metastasi ossee. Il samario 153 è sintetizzato a partire da altri isotopi dello stesso elemento esistenti in natura[1], la cui stabilità come per il 152Sm è stata oggetto di studio fin dagli anni '60[2], unitamente ad alcune affinità con altri elementi[3][4].
Storia modifica
Il samario fu individuato per la prima volta nel 1853 per via spettroscopica dal chimico svizzero Jean Charles Galissard de Marignac, che ne ipotizzò la presenza nel didimio a partire da alcune righe spettrali. Fu poi il francese Paul Émile Lecoq de Boisbaudran a isolarlo nel 1879 dalla samarskite. Sia quest'ultimo minerale sia l'elemento prendono il nome dall'ingegnere russo Samarskij.
Ruolo biologico modifica
Il samario non riveste alcun ruolo biologico noto.
Disponibilità modifica
Il samario non si trova in natura allo stato nativo; come gli altri elementi delle terre rare è contenuto in diversi minerali, tra cui la monazite, la bastnasite e la samarskite. La monazite, che ne contiene fino a 2,8%, e la bastnasite sono le principali fonti industriali di questo elemento.
Solo in tempi relativamente recenti è stato possibile isolare il samario in forma abbastanza pura attraverso tecniche di scambio ionico, estrazione in solvente e galvanostegia.
Il samario metallico è spesso preparato per elettrolisi di una miscela di cloruro di samario e cloruro di sodio o cloruro di calcio fusi. Può essere preparato anche per riduzione dei suoi sali con il lantanio.
Composti modifica
Tra i composti del samario si annoverano:
Isotopi modifica
Il samario in natura si compone dei 4 isotopi stabili 144Sm, 150Sm, 152Sm, 154Sm e dei 3 isotopi radioattivi 147Sm, 148Sm, 149Sm. Di questi 152Sm è l'isotopo più abbondante e rappresenta in 26,75% del totale.
Gli isotopi radioattivi del samario sono 32, i più stabili sono 148Sm con emivita di 7×1015 anni, 149Sm con emivita di 2×1015 anni e 147Sm con emivita di 1,06×1011 anni.
Gli altri hanno emivita inferiore a 1,04×108 anni e la maggior parte di essi inferiore a 48 secondi. Questo elemento possiede anche 5 stati metastabili di cui i più stabili sono 141mSm (emivita: 22,6 minuti), 143m1Sm (66 secondi) e 139mSm (10,7 secondi).
La principale modalità di decadimento degli isotopi più leggeri di 152Sm è la cattura elettronica con conseguente trasformazione in isotopi di promezio; quelli più pesanti subiscono invece solitamente il decadimento beta trasformandosi in isotopi dell'europio.
Precauzioni modifica
Come per gli altri lantanidi, anche i composti del samario posseggono una tossicità medio-bassa, benché non ancora studiata in dettaglio.
Note modifica
- ^ (EN) F. F. (Russ) Knapp, Ashutosh Dash, Radiopharmaceuticals for Therapy, su Google Books, Springer, 2016, p. 92, DOI:10.1007/978-81-322-2607-9, ISBN 978-81-322-2606-2, LCCN 2015960843. URL consultato il 21 maggio 2018.«Natural samarium can also be used for the production of 153Sm, and the product SA will still be sufficient for the preparation of low-SA radiopharmaceuticals.»
- ^ (EN) Gustafson, C.; Lamm, I.L.; Nilsson, B.; Nilsson, S.G., Nuclear Deformabilities in the Rare-Earth and Actinide Regions with Ther Excursions Off The Stability Line and into the Super Heavy Region, in Arkiv för Fysik, 36: 613-27(1967)., 1º gennaio 1966.«From International Symposium on Why and How Should We Investigate Nuclides Far Off the Stability Line, Lysekil, Sweden. See CONF-660817»
- ^ (EN) R.B.Firestone, V.S. Shirley, Tables of Isotopes, 8ª edizione, John Wiley and Sons, 1998. , integrabile con il The Lund/LNBL Nuclear Data Search versione 2.0 del febbraio 1999, LBNL di Berkleley in collaborazione con il Dipartimento di Fisica dell'Università di Lund (Svezia)
- ^ (EN) 153 Sm, su isotopes.gov. URL consultato il 21 maggio 2018 (archiviato dall'url originale il 22 maggio 2018).
Bibliografia modifica
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate modifica
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «samario»
- Wikimedia Commons contiene immagini o altri file su samario
Collegamenti esterni modifica
- samario, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) samarium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Samario, su periodic.lanl.gov, Los Alamos National Laboratory. URL consultato il 5 aprile 2005 (archiviato dall'url originale il 30 novembre 2010).
- (EN) Samario, su WebElements.com.
- (EN) Samario, su EnvironmentalChemistry.com.
- (EN) It's Elemental – Samarium, su education.jlab.org.
| Controllo di autorità | Thesaurus BNCF 38281 · LCCN (EN) sh85117001 · GND (DE) 4179010-8 · J9U (EN, HE) 987007553579605171 |
|---|

