Gallio (elemento chimico)
Il gallio è l'elemento chimico di numero atomico 31 e il suo simbolo è Ga. È un metallo raro, tenero e di colore argenteo. Il gallio è molto fragile a temperatura ambiente e il suo punto di fusione è di 29,76 °C, dunque può fondere se la temperatura dell'ambiente in cui si trova è di circa 30 gradi o se tenuto in mano. Quando fonde diminuisce il suo volume e quindi aumenta la sua densità. Si trova in tracce nella bauxite e in minerali di zinco.
| Gallio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | gallio, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | metalli del blocco p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 13 (IIIA), 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 5 904 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 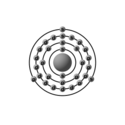 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 2Po1/2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 69,725 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 130(136) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio di van der Waals | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Ar]3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 18, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 3,1 (anfotero) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | ortorombica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 302,91 K (29,76 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 2 477 K (2 204 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 11,80×10−6 m²/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 258,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 5,59 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 9,31×10−36 Pa a 302,9 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 2740 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,81 (Scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 370 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 6,78×10−6/(m·Ω) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 40,6 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 578,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 979,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 963 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 6 180 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'arseniuro di gallio e il nitruro di gallio sono importanti semiconduttori usati in molti dispositivi elettronici, soprattutto nei diodi LED.
Caratteristiche modifica
Il gallio ad elevata purezza ha colore argento e si frattura facilmente, con fratture concoidali come quelle del vetro. Il gallio metallico si espande del 3,1% durante la solidificazione, per cui non dovrebbe mai essere tenuto in contenitori di vetro o di metallo. Inoltre il gallio è corrosivo per i metalli, perché gli atomi di gallio diffondono nella matrice cristallina metallica, formando leghe fragili.
La temperatura di fusione del gallio, ossia 29,76 °C, è prossima a quella ambiente[1], quindi si può usare in termometri per alte temperature. Ha un intervallo in fase liquida tra i più grandi[2][3], nonché il rapporto tra temperatura di ebollizione e temperatura di fusione più grande in assoluto, più di 8 volte se espresso in kelvin; ha inoltre una tensione di vapore molto bassa ad alta temperatura.
Questo metallo ha una forte tendenza a sopraraffreddarsi, cioè a restare liquido anche al disotto del suo punto di fusione; per questo è necessario mettere dei semi cristallini nella massa di gallio liquido per farlo solidificare. La densità del gallio liquido è maggiore del gallio solido, come nel caso dell'acqua; di solito per i metalli si ha l'opposto. Il gallio ad alta purezza viene lentamente attaccato dagli acidi inorganici.
Il gallio non cristallizza in nessuna delle strutture cristalline semplici: la fase stabile in condizioni normali è quella ortorombica con 8 atomi per cella cristallina. Ogni atomo ha un solo vicino più prossimo, a 2,44 Å, e altri sei atomi vicini nel raggio di 2,83 Å. Esistono molte altre fasi stabili e metastabili del gallio in varie condizioni di temperatura e pressione. Il legame chimico fra gli atomi più vicini del cristallo di gallio è di tipo covalente, per cui il dimero Ga2 è considerato il costituente principale del cristallo.
Applicazioni modifica
I circuiti integrati digitali e analogici e i dispositivi optoelettronici (diodi LED e diodi laser) sono l'applicazione più comune del gallio.
Altri usi comprendono:
- Realizzazione di specchi molto brillanti perché aderisce al vetro e alla porcellana.
- Semiconduttori e produzione componenti elettronici a stato solido come i transistor.
- Realizzazione di leghe metalliche: si usa come componente di leghe a basso punto di fusione. I pozzetti di plutonio delle armi nucleari impiegano una lega di gallio per stabilizzare una forma allotropa del plutonio. Molte ricerche sono state fatte sul gallio come sostituto del mercurio negli amalgami per odontoiatria, ma i nuovi composti devono ancora dimostrare la loro validità. L'aggiunta di gallio (fino al 2%) nelle comuni paste saldanti ne aumenta la bagnabilità e le capacità flussanti.
- Costruzione di termometri per alte temperature: una lega eutettica di gallio, indio e stagno è oggi usata al posto del mercurio nella maggior parte dei termometri clinici. Questa lega, dal nome commerciale di Galinstan, ha un punto di congelamento di −20 °C.
- Il gallato di magnesio con impurità come Mn2+ sta trovando sempre maggiore uso in materiali fosforescenti attivate da ultravioletti, che possono dar luogo a reazioni fotochimiche ritardate.[A cosa servono queste polveri?]
- Il gallio è stato impiegato negli esperimenti SAGE e GALLEX Archiviato il 30 luglio 2019 in Internet Archive. al fine di rilevare il flusso dei neutrini elettronici prodotti all'interno del Sole. Per assorbimento di un neutrino, il gallio si converte in germanio con emissione di un elettrone. Gli elettroni emessi vengono poi rilevati da fotomoltiplicatori e studiati dai fisici nucleari. È possibile che i valori di spin e momento angolare dell'atomo di gallio (−3⁄2) determinino un'instabilità dell'elemento, che potrebbe andare incontro a un decadimento spontaneo, accelerato però dall'assorbimento del neutrino elettronico.
- Drogaggio di catalizzatori per migliorarne la selettività.[4]
- L'isotopo 68 è utilizzato in medicina nucleare per la localizzazione di tumori neuroendocrini.
Usi in medicina umana modifica
Il gallio trova impiego negli ambiti sia diagnostico sia terapeutico della medicina umana. Gli isotopi 67Ga e 72Ga vengono usati come marcatori radioattivi nella diagnosi di alcune forme tumorali, come i linfomi, in virtù della predisposizione del gallio ad accumularsi maggiormente nei siti in attiva proliferazione. Inoltre il gallio costituisce un agente terapeutico nelle patologie a carattere osteolitico, per esempio il morbo di Paget, e nelle ipercalcemie, per esempio l'ipercalcemia paraneoplastica.[5]
Storia modifica
Il gallio (dal latino Gallia, che vuol dire "Francia" e anche gallus che significa gallo, l'animale da cortile) fu scoperto spettroscopicamente da Paul Émile Lecoq de Boisbaudran nel 1875 dal suo spettro caratteristico (due righe violette) esaminando una zincoblenda proveniente dai Pirenei. Prima della sua scoperta la maggior parte delle proprietà del gallio erano state previste e descritte da Dmitrij Mendeleev, che aveva chiamato eka-alluminio l'ipotetico nuovo elemento, sulla base della sua tavola periodica. Più tardi nel corso di quell'anno Boisbaudran ottenne il metallo puro tramite elettrolisi del suo idrossido in una soluzione di KOH. Egli battezzò il nuovo elemento con il nome della Francia e, con uno di quei giochi di parole multilingui molto amati dagli scienziati dell'epoca, anche con il suo: "Le coq" in francese vuol dire "il gallo".
Disponibilità modifica
Il gallio non esiste puro in natura e nemmeno esistono composti di gallio sufficientemente abbondanti da costituire una fonte estrattiva. Il gallio si ottiene dalle tracce presenti in bauxite, carbone, diaspro, germanite e sfalerite. La combustione del carbone può concentrare il gallio: alcune polveri residue della combustione contengono fino all'1,5% di gallio.
Isotopi modifica
Del gallio si conoscono almeno 31 isotopi, con numeri di massa che vanno da A = 56, ad A = 86. Tra questi, quelli presenti In natura sono i due isotopi che seguono, entrambi stabili: 69Ga (60,108%, spin 3/2-, il più abbondante) e 71Ga (39,892%, spin3/2-).[6]
Isotopi radioattivi modifica
Il 67Ga (spin 3/2-) non è stabile; decade per cattura elettronica (ε) a zinco-67, stabile, rilasciando un'energia pari a 1,001 MeV. questo valore è appena minore di 1,022 MeV (l'equivalente della massa di 2 elettroni) e pertanto il decadimento β+, che normalmente è in competizione con la cattura elettronica, in questo caso non può avvenire.[7] L'emivita dell'isotopo è di 3,262 giorni, che poi decade a sua volta, ancora in modalità β+, a titanio-48, stabile.[8]
Il 68Ga (spin 1) non è stabile; decade per emissione di positrone (β+) a zinco-68, stabile (Q = 1,899 keV, T1/2 = 1,129 ore).[9]
Il 70Ga (spin 1), che si trova in mezzo ai due isotopi stabili, non è stabile e decade secondo due modalità opposte: per 99,59% decade β+ a dare zinco-70 (Q = 1,635 MeV) e, per lo 0,41% decade β- a dare germanio-70 (Q = 654,56 keV), stabile; poi, lo zinco-70 così prodotto decade a sua volta a germanio-70 (doppio decadimento β-). L'emivita è di 21,13 minuti.[10]
Il 72Ga (spin 3-) non è stabile; decade β- a germanio-72, stabile (Q = 3,997 MeV, T1/2 = 14,11 ore).[11]
Il 73Ga (spin 3-) non è stabile; decade β- a germanio-73, stabile (Q = 1,598 MeV, T1/2 = 4,861 ore).[12]
Il 74Ga (spin 3-) non è stabile; decade β- a germanio-74, stabile (Q = 5,373 MeV, T1/2 = 8,117 ore).[13]
Il 75Ga (spin 3-) non è stabile; decade β- a germanio-75 (Q = 3,392 MeV, T1/2 = 2,1 minuti); poi, il germanio-75 così prodotto decade a sua volta in arsenico-75, stabile.[14]
Precauzioni modifica
Anche se non è considerato tossico, i dati sull'effetto fisiologico del gallio non sono definitivi. Alcune fonti riportano che una prolungata esposizione al gallio può provocare dermatite, ma altri test non hanno dato tale risultato.
Note modifica
- ^ In genere come "temperatura ambiente" si assume la temperatura di 25 °C (ovvero 298 K), per cui gli unici elementi metallici che abbiano una temperatura di fusione minore di questa sono bromo (Tfus = 265,95 K) e mercurio (Tfus = 234,32 K), ma, siccome nella sua accezione più generale la temperatura ambiente può essere qualsiasi temperatura compatibile con le condizioni meteorologiche, si può dire che anche gli elementi metallici cesio (Tfus = 301,59 K), gallio (Tfus = 302,91 K), francio (Tfus = 300,15 K) e rubidio (Tfus = 312,46 K) sono liquidi a temperature "prossime" a quella ambiente.
- ^ http://www.webelements.com/periodicity/liquid_range/
- ^ http://www.chemicool.com/elements/gallium.html
- ^ (EN) Christof Aellig, David Scholz e Pierre Y. Dapsens, When catalyst meets reactor: continuous biphasic processing of xylan to furfural over GaUSY/Amberlyst-36, in Catal. Sci. Technol., vol. 5, n. 1, pp. 142–149, DOI:10.1039/c4cy00973h. URL consultato il 2 febbraio 2016.
- ^ R. Bockman, The effects of gallium nitrate on bone resorption, in Seminars in Oncology, 30 (2 Suppl 5), 2003, pp. 5-12.
- ^ Isotope data for gallium-69 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Aditya Katragada e Oliver Manuel, Nuclear systematics: IV. Asymmetry between matter and anti-matter (PDF), in Journal of Radioanalytical and Nuclear Chemistry, p. 4.
- ^ Isotope data for gallium-67 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-68 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-70 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-72 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-73 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-74 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
- ^ Isotope data for gallium-75 in the Periodic Table, su periodictable.com. URL consultato il 17 marzo 2023.
Bibliografia modifica
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate modifica
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «gallio»
- Wikimedia Commons contiene immagini o altri file su Gallio
Collegamenti esterni modifica
- gallio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) gallium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Gallio, su EnvironmentalChemistry.com.
- (EN) Gallio, su periodic.lanl.gov, Los Alamos National Laboratory. URL consultato il 29 gennaio 2005 (archiviato dall'url originale il 6 febbraio 2006).
- Treccani, su treccani.it. URL consultato il 26 novembre 2019 (archiviato dall'url originale il 23 novembre 2019).
| Controllo di autorità | Thesaurus BNCF 69456 · LCCN (EN) sh85052848 · GND (DE) 4155859-5 · BNE (ES) XX536285 (data) · BNF (FR) cb11955437j (data) · J9U (EN, HE) 987007558076805171 · NDL (EN, JA) 00562254 |
|---|
