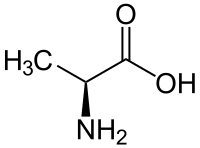
Amminoacido
Gli amminoacidi sono una vasta categoria di molecole organiche che hanno sia il gruppo funzionale amminico (), sia quello carbossilico (). La parola amminoacido deriva dall'unione dei nomi di questi due gruppi funzionali. Siccome presentano contemporaneamente un gruppo acido (quello carbossilico) e un gruppo basico (quello amminico), sono definite molecole anfotere. In funzione del valore del pH dell'ambiente chimico in cui si trova la molecola, i due gruppi possono essere neutri o ionizzati. In condizioni fisiologiche, gli amminoacidi presentano il gruppo acido carico negativamente () e quello basico carico positivamente (): se l'amminoacido non ha altre cariche, allora prende il nome di zwitterione, in quanto la sua carica globale sarà neutra; se globalmente è carico positivamente sarà un catione, altrimenti un anione.
In biochimica, con il termine amminoacido ci si riferisce generalmente ad un piccolo sottogruppo di questi: gli L-α-amminoacidi, cioè amminoacidi i cui gruppi amminico e carbossilico sono legati allo stesso atomo di carbonio, chiamato α, e la cui configurazione è L (ovvero il gruppo amminico si trova a sinistra del carbonio α nella proiezione di Fischer della molecola). Gli L-α-amminoacidi che costituiscono la struttura primaria delle proteine sono 22;[1][2] per questo motivo vengono definiti amminoacidi proteinogenici. Il legame covalente che unisce il gruppo di un amminoacido con quello di un altro amminoacido è definito legame peptidico o giunto peptidico. Le catene di amminoacidi sono indicate col termine di peptidi e possono contenere un numero molto variabile di unità: catene molto corte vengono chiamate dipeptidi o tripeptidi (se composti rispettivamente da 2 o 3 amminoacidi), catene di medie dimensioni vengono definite oligopeptidi, catene molto lunghe polipeptidi.
Gli amminoacidi non proteinogenici invece, sono tutti gli amminoacidi non coinvolti nella struttura delle proteine. Questi rappresentano il gruppo più numeroso di amminoacidi e se ne possono identificare migliaia.
Storia modifica
Il primo amminoacido venne scoperto nel 1806, quando i chimici francesi Louis-Nicolas Vauquelin e Pierre Jean Robiquet isolarono un composto dagli asparagi: l'asparagina.[3] Nel 1810 invece, si scoprì la cistina, una molecola composta da due amminoacidi legati assieme. La cistina fu quindi il primo amminoacido non proteinogenico scoperto, mentre la cisteina, l'amminoacido che compone la cistina, venne scoperta solo nel 1884.[3] Nel 1935 venne scoperto da William Cumming Rose l'ultimo amminoacido proteinogenico: la treonina. Rose classificò anche gli amminoacidi in essenziali e non, stabilendo il loro fabbisogno giornaliero minimo.[4][5]
In passato non si sapeva che gli amminoacidi fossero i componenti delle proteine. Fu nel 1902 che Emil Fischer propose la sua teoria, poi rilevatasi corretta, che le proteine fossero formate da molti amminoacidi legati tra loro e con il gruppo amminico di un amminoacido unito al gruppo carbossilico di un altro, dando luogo a una struttura lineare a catena che Fischer chiamava "peptide".[6]
Struttura modifica
Affinché una molecola possa essere definita amminoacido, deve avere almeno un gruppo funzionale derivato dalle ammine ( ) e uno derivato dagli acidi carbossilici ( ). Questo non esclude la presenza di più gruppi amminici o di più gruppi carbossilici, come ad esempio accade nella molecola di asparagina o di acido glutammico. In base a questa proprietà, gli amminoacidi sono dunque sostanze anfotere.
Il primo atomo di carbonio legato al gruppo carbossilico viene convenzionalmente chiamato α, il secondo β, il terzo γ e così via. Qualora il gruppo amminico sia legato al carbonio-α, l'amminoacido apparterrà alla sottocategoria degli α-amminoacidi,[7] se invece il gruppo amminico è legato al Cβ, si identificheranno i β-amminoacidi e così via per ogni carbonio. Spesso, legati ai carboni della catena principale Cα-Cβ-Cγ-ecc., ci possono essere sostituenti generici ( ) di varia natura.
Dissociazione modifica
In soluzione acquosa, gli amminoacidi tendono a dissociarsi a livello dei loro gruppi amminici e carbossilici.[8] A seconda dell'acidità della soluzione, la dissociazione può produrre molecole cariche positivamente, negativamente o neutre con cariche delocalizzate che complessivamente si bilanciano.
Ciò accade perché a pH acidi, dunque quando la soluzione abbonda di protoni, i gruppi come si associano a questi protoni, formando . A pH basici invece, i gruppi come si dissociano in . Ne consegue che a pH neutri, come quelli del sangue (7,4) o dell'acqua pura (7), molti degli amminoacidi si trovano con cariche positive e negative che complessivamente si bilanciano. Questa struttura molecolare è definita zwitterione.
Non sempre la forma zwitterionica si ottiene raggiungendo pH neutri. Per gli amminoacidi che hanno più gruppi basici o acidi, la forma zwitterionica è raggiunta a pH non neutri. Ad esempio l'acido glutammico, che ha un gruppo carbossilico in più all'estremità della catena laterale , raggiunge la sua forma zwitterionica a pH 3, dunque in ambiente acido.[9]
Il valore esatto di pH per il quale un composto esiste sotto forma zwitterionica è definito punto isoelettrico e dipende dalla costante di dissociazione acida e basica dei vari gruppi presenti nella molecola.
Catena laterale modifica
La catena laterale di un amminoacido viene convenzionalmente chiamata gruppo R, questo perché in chimica organica il sostituente indica un generico sostituente che è di natura alchilica o che inizia come tale e che poi può contenere altri gruppi funzionali. In questo modo, la definizione di catena laterale degli amminoacidi acquisisce un senso ampio, in quanto comprende una vasta gamma di gruppi chimici.
In funzione delle proprietà chimiche del gruppo R, un amminoacido viene classificato come acido, basico, idrofilo o idrofobo. Esempi di catene laterali acide sono quelle degli amminoacidi acido aspartico e acido glutammico, mentre esempi di gruppi R basici sono quelli di asparagina e lisina.
La catena laterale assume un ruolo fondamentale nelle interazioni tra amminoacidi. Quando questi si legano assieme, possono anche formare catene molto lunghe definite proteine. Le proteine hanno quindi una struttura lineare di base, definita struttura primaria. Tridimensionalmente però, le proteine non assomigliano a catene lineari, questo perché ripiegano la loro struttura primaria fino a formare gomitoli e filamenti. Il ripiegamento tridimensionale delle proteine è guidato dalle proprietà chimiche delle catene laterali. Se il loro ingombro sterico non lo permette, la proteina non si ripiegherà come previsto e non funzionerà. Così accade anche se la loro idrofobicità, la loro acidità o la loro basicità non lo permette.
Isomeria modifica
Quando un atomo di carbonio porta legati 4 differenti gruppi funzionali ( , , e un atomo di idrogeno) viene definito elemento stereogenico, ossia elemento in grado di generare stereoisomeri. Quando ciò accade la molecola può essere identificata come L-amminoacido o D-amminoacido. Se i 4 gruppi funzionali sono legati al Cα, si parlerà di L-α-amminoacidi. Essi sono gli amminoacidi che compongono tutte le proteine degli esseri viventi e per tale motivo vengono definiti amminoacidi proteinogenici. Gli D-α-amminoacidi possono talvolta entrare a far parte delle glicoproteine di alcuni esseri viventi, come accade nei procarioti, ma generalmente hanno funzioni differenti e per tale motivo rientrano nel grande gruppo di amminoacidi non proteinogenici.[10]
Talvolta capita che gli amminoacidi abbiano più stereocentri, come ad esempio accade per la cistina e la cistationina. In questi casi si utilizza il sistema di nomenclatura assoluta R/S (che riguarda i singoli atomi), preferendolo al sistema di Fischer-Rosanoff (D/L).[11]
La glicina invece, rappresenta un'eccezione tra gli amminoacidi proteinogenici in quanto priva di stereocentri, è dunque l'unico amminoacido proteinogenico non chirale.
Proprietà chimico-fisiche modifica
Amminoacidi proteinogenici modifica
Gli amminoacidi che prendono parte alla sintesi proteica hanno tutti una struttura simile:[12]
- Hanno il gruppo amminico, il gruppo carbossilico, il gruppo R e un atomo di idrogeno sul Cα;
- Il Cα è uno stereocentro in configurazione L;
- Il gruppo amminico è derivato da un'ammina primaria.
A queste regole strutturali, la glicina e la prolina fanno eccezione: la glicina non ha uno stereocentro al Cα, la prolina è un'ammina secondaria.
Di seguito sono riassunte le principali proprietà chimico-fisiche degli L-α-amminoacidi proteinogenici:
| Abbreviazione | Nome completo | Struttura | Catena laterale | Indice idrofobico[13] | Peso molecolare | Punto isoelettrico | Costante di dissociazione | Frequenza nelle proteine (%)[14] | ||||
| 1 lettera | 3 lettere | Tipo | Polarità | |||||||||
| A | Ala | Alanina | Alifatica | Apolare | 1,8 | 89,09404 | 6,11 | 2,35 | 9,87 | - | 8,76 | |
| C | Cys | Cisteina | Tiolica | Acida | 2,5 | 121,15404 | 5,05 | 1,92 | 10,70 | 8,37 | 1,38 | |
| D | Asp | Acido aspartico | Anionica | Acida | -3,5 | 133,10384 | 2,85 | 1,99 | 9,90 | 3,90 | 5,49 | |
| E | Glu | Acido glutammico | Anionica | Acida | -3,5 | 147,13074 | 3,15 | 2,10 | 9,47 | 4,07 | 6,32 | |
| F | Phe | Fenilalanina | Aromatica | Apolare | 2,8 | 165,19184 | 5,49 | 2,20 | 9,31 | - | 3,87 | |
| G | Gly | Glicina | Alifatica | Apolare | -0,4 | 75,06714 | 6,06 | 2,35 | 9,78 | - | 7,03 | |
| H | His | Istidina | Aromatica | Acida e basica | -3,2 | 155,15634 | 7,60 | 1,80 | 9,33 | 6,04 | 2,26 | |
| I | Ile | Isoleucina | Alifatica | Apolare | 4,5 | 131,17464 | 6,05 | 2,32 | 9,76 | - | 5,49 | |
| K | Lys | Lisina | Cationica | Basica | -3,9 | 146,18934 | 9,60 | 2,16 | 9,06 | 10,54 | 5,19 | |
| L | Leu | Leucina | Alifatica | Apolare | 3,8 | 131,17464 | 6,01 | 2,33 | 9,74 | - | 9,68 | |
| M | Met | Metionina | Tioeterica | Apolare | 1,9 | 149,20784 | 5,74 | 2,13 | 9,28 | - | 2,32 | |
| N | Asn | Asparagina | Ammidica | Polare | -3,5 | 132,11904 | 5,41 | 2,14 | 8,72 | 3,93 | ||
| O | Pyl | Pirrolisina | Ammidica | Polare | 255,313 | |||||||
| P | Pro | Prolina | Ciclica | Apolare | -1,6 | 115,13194 | 6,30 | 1,95 | 10,64 | - | 5,02 | |
| Q | Gln | Glutammina | Ammidica | Polare | -3,5 | 146,14594 | 5,65 | 2,17 | 9,13 | 3,90 | ||
| R | Arg | Arginina | Cationica | Basica | -4,5 | 174,20274 | 10,76 | 1,82 | 8,99 | 12,48 | 5,78 | |
| S | Ser | Serina | Idrossilica | Polare | -0,8 | 105,09344 | 5,68 | 2,19 | 9,21 | 7,14 | ||
| T | Thr | Treonina | Idrossilica | Polare | -0,7 | 119,12034 | 5,60 | 2,09 | 9,10 | 5,53 | ||
| U | Sec | Selenocisteina | Selenica | Polare | 168,064 | |||||||
| V | Val | Valina | Alifatica | Apolare | 4,2 | 117,14784 | 6,00 | 2,39 | 9,74 | - | 6,73 | |
| W | Trp | Triptofano | Aromatica | Apolare | -0,9 | 204,22844 | 5,89 | 2,46 | 9,41 | - | 1,25 | |
| Y | Tyr | Tirosina | Aromatica | Polare | -1,3 | 181,19124 | 5,64 | 2,20 | 9,21 | 10,46 | 2,91 | |
Amminoacidi non proteinogenici modifica
Gli amminoacidi non proteinogenici sono definiti come tutti gli amminoacidi che non prendono parte alla sintesi proteica. A seconda della molecola considerata le proprietà chimico-fisiche possono variare di molto.
Utilizzi modifica
In natura modifica
La funzione principale degli L-α-amminoacidi è quella di essere i costituenti fondamentali delle proteine.[15] La struttura primaria di una proteina, ovvero la sua struttura lineare, è composta da una catena di amminoacidi uniti da legami covalenti. Il numero di amminoacidi che possono comporre una proteina è molto variabile: l'insulina ad esempio, è composta da due catene di 21 e 30 amminoacidi, per un totale di 51,[16] la titina invece è composta da circa 27.000 amminoacidi, che possono diventare 33000 a seconda dell'isoforma considerata.[17] Quest'enorme variabilità rispecchia l'enorme numero di possibili proteine che si trovano in natura.
Un'altra funzione degli L-α-amminoacidi è quella di agire come neurotrasmettitori: l'acido glutammico ad esempio, è il principale neurotrasmettitore eccitatorio del sistema nervoso centrale.[18] La glicina invece, è un neurotrasmettitore inibitorio del sistema nervoso.
Alcuni amminoacidi non proteinogenici sembrano essere inclusi nelle strutture proteiche. Ciò accade perché gli L-α-amminoacidi possono venire modificati dopo la loro inclusione nelle proteine. Un esempio è l'idrossiprolina, derivata dalla prolina, che è un componente importante del collagene. Allo stesso modo, in alcune proteine dei procarioti, avviene l'inclusione degli D-α-amminoacidi. La D-alanina ad esempio, è un componente fondamentale del peptidoglicano, la glicoproteina che riveste alcuni batteri.
Gli D-α-amminoacidi agiscono anche come antibiotici e come neuromodulatori a livello cerebrale.[19] Ad esempio, nel cervello dei mammiferi, la D-serina agisce come co-agonista dei recettori NMDA.[20] Lo stesso acido N-metil-D-aspartico (NMDA), la molecola che si lega ai recettori appena citati, è un D-α-amminoacido modificato.
Il GABA, un γ-amminoacido, è il principale neurotrasmettitore inibitore del sistema nervoso. Gli amminoacidi non proteinogenici si trovano spesso come intermedi delle vie metaboliche; ad esempio la carnitina, un amminoacido il cui gruppo amminico è derivato dall'ammonio, è usata nel trasporto dei lipidi. L'ornitina e la citrullina sono intermedi del ciclo dell'urea. La β-alanina, un β-amminoacido, è usato dalle piante per la sintesi dell'acido pantotenico (vitamina B5).[21] Alcuni aminoacidi non proteinogenici sono usati dalle piante come difese contro gli erbivori.[22] Ad esempio la canavanina, che abbonda in molti legumi,[23] è il motivo per cui questi debbano essere opportunamente cotti prima di essere mangiati.
Nell'industria modifica
L'uso principale che si fa degli amminoacidi in campo industriale è come additivi nella produzione di mangimi per l'alimentazione animale. Questo accade perché spesso, i componenti dei mangimi come la soia o il mais hanno bassi livelli o mancano di alcuni amminoacidi essenziali.[24] In questo settore, gli amminoacidi vengono utilizzati anche per chelare gli ioni metallici al fine di migliorarne l'assorbimento.[25]
Nell'industria alimentare umana si utilizza l'acido glutammico come esaltatore di sapidità[26] e l'aspartame come dolcificante artificiale a basso contenuto calorico.[27] Una tecnologia simile a quella utilizzata per l'alimentazione animale è impiegata nell'industria della nutrizione umana per alleviare i sintomi delle carenze minerali, come l'anemia, migliorando l'assorbimento dei minerali e riducendo gli effetti collaterali negativi dell'integrazione di minerali inorganici.[28]
La capacità chelante degli aminoacidi è stata utilizzata nei fertilizzanti per l'agricoltura per facilitare la consegna di minerali alle piante al fine di correggere le carenze minerali, come la clorosi ferrosa. Questi fertilizzanti vengono utilizzati anche per prevenire il verificarsi di carenze e per migliorare la salute generale delle piante.[29]
Nell'industria farmaceutica vengono utilizzati alcuni amminoacidi o molecole derivate da essi. Il 5-idrossitriptofano è utilizzato per il trattamento sperimentale della depressione,[30] l'L-DOPA per il trattamento del Parkinson[31] e l'eflornitina per l'inibizione dell'enzima ornitina decarbossilasi e nel trattamento della malattia del sonno.[32]
Nella ricerca modifica
Dal 2001, 40 amminoacidi non proteinogenici sono stati aggiunti alle proteine creando un codone unico ricodificante e una corrispondente coppia transfer-RNA:amminoacil – tRNA-sintetasi per codificarla con diverse proprietà fisico-chimiche e biologiche, in modo da essere utilizzata come uno strumento per esplorare la struttura e la funzione delle proteine o per creare proteine nuove o migliorate.[33][34]
Gli amminoacidi sono stati considerati come componenti di polimeri biodegradabili, che hanno applicazioni come imballaggi ecologici, e in medicina nella somministrazione di farmaci e nella costruzione di impianti protesici.[35] Un esempio interessante di tali materiali è il poliaspartato, un polimero biodegradabile solubile in acqua che può avere applicazioni nei pannolini usa e getta e nell'agricoltura.[36] Grazie alla sua solubilità e alla capacità di chelare gli ioni metallici, il poliaspartato viene utilizzato anche come agente anticalcare biodegradabile e inibitore di corrosione.[37] Inoltre, l'amminoacido aromatico tirosina è stato considerato un possibile sostituto di fenoli come il bisfenolo A nella produzione di policarbonati.[38]
Sintesi modifica
Biosintesi degli amminoacidi proteinogenici modifica
Nell'uomo modifica
Dei 22 amminoacidi proteinogenici, 9 sono definiti essenziali per l'uomo, in quanto non possono essere prodotti partendo da altri composti dal corpo umano e quindi devono essere assunti come cibo. Questi 9 amminoacidi (fenilalanina, isoleucina, istidina, leucina, lisina, metionina, treonina, triptofano e valina), ritenuti essenziali per la sopravvivenza umana, non lo sono per piante o procarioti, che possiedono differenti vie di biosintesi. Gli altri 13 amminoacidi non essenziali per l'uomo vengono sintetizzati attraverso vie metaboliche specifiche.
Nelle piante modifica
Nelle piante, l'azoto viene prima assimilato in composti organici sotto forma di glutammato, formandosi da alfa-chetoglutarato e ammoniaca nel mitocondrio. Per altri amminoacidi, le piante usano le transaminasi per spostare il gruppo amminico dal glutammato a un altro alfa-chetoacido. Ad esempio, l'aspartato aminotransferasi converte il glutammato e l'ossalacetato in alfa-chetoglutarato e aspartato.[39] Anche altri organismi usano le transaminasi per la sintesi degli aminoacidi.
Nei procarioti modifica
L'amminoacido pirrolisina è utilizzato esclusivamente dai procarioti, che lo producono attraverso una reazione tra due molecole di L-lisina. Una molecola di lisina viene prima convertita in (3R)-3-metil-D-ornitina, che viene poi legata a una seconda lisina. Un gruppo amminico viene eliminato, seguito da ciclizzazione e disidratazione per produrre L-pirrolisina.[40]
Biosintesi degli amminoacidi non proteinogenici modifica
Gli amminoacidi non standard si formano solitamente attraverso modifiche agli amminoacidi standard. Ad esempio, l'omocisteina si forma attraverso la via della transsolforazione o dalla demetilazione della metionina attraverso il metabolita intermedio S-adenosilmetionina,[41] mentre l'idrossiprolina è prodotta da una modifica post-traduzionale della prolina.[42] I microrganismi e le piante sintetizzano molti aminoacidi non comuni. Ad esempio, alcuni microbi producono acido 2-aminoisobutirrico e lantionina, che è un derivato dell'alanina a ponte sul solfuro. Entrambi questi amminoacidi si trovano nei lantibiotici peptidici come l'alameticina.[43] Tuttavia, nelle piante, l'acido 1-aminociclopropano-1-carbossilico è un piccolo amminoacido ciclico disostituito intermedio nella produzione dell'ormone vegetale etilene.[44]
Sintesi chimica degli amminoacidi proteinogenici modifica
La produzione commerciale di amminoacidi di solito si basa su batteri mutanti che producono in eccesso i singoli amminoacidi utilizzando il glucosio come fonte di carbonio. Alcuni amminoacidi sono prodotti da conversioni enzimatiche di intermedi sintetici. L'acido 2-aminotiazolino-4-carbossilico è un intermedio in una sintesi industriale della L-cisteina, ad esempio. L'acido aspartico è prodotto dall'aggiunta di ammoniaca al fumarato usando una liasi.[45]
Sintesi chimica degli amminoacidi non proteinogenici modifica
In laboratorio, la maggior parte degli amminoacidi non proteinogenici viene prodotta attraverso sintesi di Strecker o amminazione riduttiva su derivati della condensazione di Claisen. Un'ulteriore via di sintesi è la sintesi asimmetrica, mediante reattivo di Corey, su α-chetoesteri. A differenza dei precedenti metodi, la sintesi asimmetrica è enantioselettiva, cioè permette di ottenere D-amminoacidi o L-amminoacidi in maniera controllata.
Reazioni modifica
Il codice genetico modifica
Diversi studi evolutivi indipendenti hanno suggerito che Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr possono appartenere a un gruppo di aminoacidi che costituivano il codice genetico iniziale, mentre Cys, Met, Tyr, Trp, His, Phe potrebbe appartenere a un gruppo di amminoacidi che costituirono successive aggiunte del codice genetico.[46][47][48][49]
Il codice genetico è quell'insieme di regole che associano l'informazione genetica alla struttura primaria di una proteina: la sequenza di basi azotate presenti sul DNA si ripercuote grazie al codice genetico sulla sequenza di amminoacidi delle proteine. Siccome gli amminoacidi proteinogenici sono 22, e solo 4 le basi azotate, il codice genetico deve trovare un metodo per associare le basi azotate agli amminoacidi:
- Se associasse ad ogni base un amminoacido non ci sarebbero abbastanza combinazioni (A, T, C, G) per coprire tutti e 22 gli amminoacidi (41 = 4);
- Se associasse ad ogni gruppo di 2 basi un amminoacido non ci sarebbero abbastanza combinazioni (AA, AT, AG, AC, TA, TT, ecc.) per coprire tutti e 22 gli amminoacidi (42 = 16);
- Se associasse ad ogni gruppo di 3 basi un amminoacido ci sarebbero abbastanza combinazioni (AAA, AAT, AAC, AAG, ecc.) per coprire tutti e 22 gli amminoacidi (43 = 64). In questo caso, le triplette di basi azotate in eccesso sarebbero associate agli stessi amminoacidi, creando così una ridondanza: meccanismo di difesa contro le mutazioni genetiche.
Quello che è accaduto in natura è la terza ipotesi.
La sintesi proteica modifica
Gli amminoacidi sono gli elementi costitutivi delle proteine.[50] Il processo che li lega in una catena lineare breve o lunga che sia, si chiama sintesi proteica e si compone di diverse fasi dal punto di vista degli amminoacidi.
Formazione del complesso tRNA-amminoacile modifica
L'RNA transfer si lega ad un amminoacido attraverso una reazione catalizzata da un enzima. Ogni amminoacido ha il suo RNA transfer e il suo enzima che lo lega a quest'ultimo che appartiene alla categoria tRNA sintetasi.
Formazione del complesso tRNA-amminoacile-mRNA modifica
Sul ribosoma, quando passa l'RNA messaggero, il complesso tRNA-amminoacile precedentemente sintetizzato viene richiamato e si lega al mRNA in corrispondenza delle 3 basi azotate del codice genetico. Queste 3 basi, che sull'RNA messaggero si chiamano codoni, sull'RNA transfer si chiamano anticodoni.
Formazione del legame peptidico modifica
Quando il ribosoma si sposta, richiama un secondo tRNA-amminoacile, che si posiziona adiacentemente al primo. Dunque i due amminoacidi si trovano molto vicini e una porzione del ribosoma li unisce con una reazione di condensazione. A seconda della lunghezza della catena, si identificano brevi catene polimeriche chiamate peptidi o catene più lunghe chiamate polipeptidi o proteine. Queste catene sono lineari e non ramificate, con ciascun residuo di amminoacido all'interno della catena attaccato a due amminoacidi vicini.
H2N-CH-COOH + H2N-CH-COOH → H2N-CH-CO-NH-CH-COOH + H2O
| | | |
R R' R R'
Il legame covalente che unisce i due amminoacidi, evidenziato in rosso, prende anche il nome in biochimica di "legame peptidico" o "giunto peptidico". Si noti come l'unione di due o più amminoacidi lasci alle due estremità della catena altri due gruppi liberi, che possono ulteriormente reagire legandosi ad altri amminoacidi (reazioni di questo genere rientrano nella classe più generale delle polimerizzazioni per condensazione). Una catena di più amminoacidi legati attraverso legami peptidici prende il nome generico di polipeptide o di oligopeptide se il numero di amminoacidi coinvolti è limitato; uno o più polipeptidi, a volte accompagnati da altre strutture ausiliarie o ioni dette cofattori o gruppi prostetici, costituiscono una proteina.
Gli amminoacidi che compaiono nelle proteine di tutti gli organismi viventi sono 20 (anche se evidenze recenti suggeriscono che questo numero potrebbe aumentare fino a 23, vedi più sotto) e sono sotto il controllo genetico, nel senso che l'informazione del tipo e della posizione di un amminoacido in una proteina è codificata nel DNA. Talvolta, nelle proteine compaiono anche altri amminoacidi, più rari, detti occasionali che vengono prodotti per modifiche chimiche successive alla biosintesi della proteina, che avviene sul ribosoma.
In natura sono stati finora scoperti oltre 500 amminoacidi diversi che non fanno parte di proteine e svolgono ruoli biologici diversi. Alcuni sono stati addirittura trovati nelle meteoriti, soprattutto in quelle del tipo carbonaceo. In quella caduta su Murchison il 28 settembre 1969, ne vennero individuati 74 tipi differenti, di cui 8 presenti nelle proteine[51]. Piante e batteri sono in grado di biosintetizzare amminoacidi particolari, che possono essere trovati, per esempio, negli antibiotici peptidici, ad esempio la nisina e l'alameticina. La lantionina è un solfuro dimero dell'alanina che si trova insieme ad amminoacidi insaturi nei lantibiotici, ovvero antibiotici peptidici di origine batterica. L'acido 1-amminociclopropan-1-carbossilico (ACC) è un semplice amminoacido ciclico disostituito che funge da intermedio nella sintesi dell'etilene, che per gli organismi vegetali è un ormone.
Oltre a quelli coinvolti nella biosintesi delle proteine, vi sono amminoacidi che svolgono importanti funzioni biologiche quali la glicina, l'acido γ-amminobutirrico (GABA, un γ amminoacido) e l'acido glutammico (tre neurotrasmettitori), la carnitina (coinvolta nel trasporto dei lipidi all'interno della cellula), l'ornitina, la citrullina, l'omocisteina, l'idrossiprolina, l'idrossilisina e la sarcosina.
Dei venti amminoacidi proteici, alcuni sono definiti "essenziali"[52]. Un amminoacido è definito essenziale se all'interno dell'organismo non sono presenti le strutture (enzimi, proteine di sintesi) necessarie a biosintetizzarlo; è perciò necessario che questo amminoacido venga introdotto con la dieta. Gli amminoacidi essenziali sono la lisina, la leucina, l'isoleucina, la metionina, la fenilalanina, la treonina, il triptofano, la valina e l'istidina. Riguardo all'istidina, è importante precisarne l'essenzialità: l'istidina è un amminoacido essenziale durante tutta la vita, ma durante l'età adulta il fabbisogno non è molto rilevante, poiché l'organismo riesce a conservarla in modo particolarmente efficiente, riducendone la richiesta biologica. Nei bambini e nelle donne in gravidanza la richiesta di istidina invece è molto più alta perché questo meccanismo non si è ancora sviluppato.
Esistono poi amminoacidi condizionatamente essenziali, ossia che devono essere assunti con la dieta solo in alcuni periodi della vita o a causa di alcune patologie. Di questo gruppo fanno parte l'arginina (è sintetizzata dall'organismo come derivato del glutammato prodotto nel Ciclo di Krebs, ma nelle donne in gravidanza e nei bambini la sua produzione non è sufficiente a coprire il fabbisogno dell'organismo, perciò deve essere assunta con la dieta), la tirosina (è prodotta a partire dall'amminoacido essenziale fenilalanina, perciò è necessario assumere quest'ultima con la dieta per sintetizzarla; inoltre non sono infrequenti i casi di fenilchetonuria, una patologia che descrive l'incapacità dell'organismo di metabolizzare la fenilalanina, che perciò non è trasformata in tirosina e si accumula provocando gravi danni all'organismo), e la cisteina (per la sua sintesi, derivata dalla glicolisi, è necessario il contributo della metionina, un altro amminoacido essenziale, perché rende possibile la presenza del gruppo sulfidrilico della cisteina). Va infine precisato che il concetto di essenzialità varia a seconda degli organismi[53][54].
Una nota particolare meritano due amminoacidi, detti occasionali,: la selenocisteina, corrispondente a un codone UGA che normalmente è un codone di interruzione[55], e la pirrolisina, presente negli enzimi di alcuni batteri metanogeni coinvolti nel processo di generazione del metano, corrispondente a un codone UAG[56]. La scoperta del primo, nel 1986, venne interpretata dalla comunità scientifica come un fenomeno marginale e ristretto. Tuttavia, dopo la scoperta del secondo amminoacido extra, nel 2004, la comunità scientifica internazionale sta rivedendo le sue posizioni, e si è aperta la caccia ad altri amminoacidi extra.
Reazione di protonazione/deprotonazione modifica
Dal valore del pKa dei gruppi amminico e carbossilico e alcuni gruppi laterali, e quindi dalla posizione dei relativi equilibri acido/base, si possono ricavare informazioni sulla carica parziale nei differenti valori di pH; in una soluzione neutra:[57]
- Il gruppo carbossilico è preferibilmente carico negativo.
- Il gruppo amminico è preferibilmente carico positivo.
- Il gruppo R dell'aspartato e glutammato è preferibilmente carico negativamente.
- Il gruppo R della lisina e arginina è a pH 7 preferibilmente carico positivamente.
- Il gruppo R della tirosina è per lo più neutro.
- Il gruppo R dell'istidina ha il 10% di probabilità di essere carico positivo a pH 7, ma la probabilità aumenta fino al 50% in soluzioni a pH 6. Per questo l'istidina è molto sensibile alle variazioni di pH nell'intervallo fisiologico.
Note modifica
- ^ Michael Rother e Joseph A. Krzycki, Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea, in Archaea (Vancouver, B.C.), vol. 2010, 17 agosto 2010, DOI:10.1155/2010/453642. URL consultato il 16 aprile 2018.
- ^ T. C. Stadtman, Selenium biochemistry, in Science (New York, N.Y.), vol. 183, n. 4128, 8 marzo 1974, pp. 915–922. URL consultato il 16 aprile 2018.
- ^ a b Hubert Bradford. Vickery e Carl L. A. Schmidt, The History of the Discovery of the Amino Acids., in Chemical Reviews, vol. 9, n. 2, 1º ottobre 1931, pp. 169–318, DOI:10.1021/cr60033a001. URL consultato il 7 marzo 2022.
- ^ (EN) Robert D. Simoni, Robert L. Hill e Martha Vaughan, The Discovery of the Amino Acid Threonine: the Work of William C. Rose, in Journal of Biological Chemistry, vol. 277, n. 37, 13 settembre 2002, pp. 56–58, DOI:10.1016/S0021-9258(20)74369-3. URL consultato il 7 marzo 2022.
- ^ FEEDING EXPERIMENTS WITH MIXTURES OF HIGHLY PURIFIED AMINO ACIDS, su jbc.org.
- ^ Joseph S. Fruton, Contrasts in scientific style : research groups in the chemical and biochemical sciences, 1990, ISBN 0-87169-191-4, OCLC 22700450. URL consultato il 7 marzo 2022.
- ^ (EN) Medical Definition of ALPHA-AMINO ACID, su www.merriam-webster.com. URL consultato l'8 marzo 2022.
- ^ (EN) Jacinto Sandoval-Lira, Gustavo Mondragón-Solórzano e Leonardo I. Lugo-Fuentes, Accurate Estimation of p K b Values for Amino Groups from Surface Electrostatic Potential ( V S,min ) Calculations: The Isoelectric Points of Amino Acids as a Case Study, in Journal of Chemical Information and Modeling, vol. 60, n. 3, 23 marzo 2020, pp. 1445–1452, DOI:10.1021/acs.jcim.9b01173. URL consultato il 22 aprile 2022.
- ^ H. X. Liu, R. S. Zhang e X. J. Yao, Prediction of the isoelectric point of an amino acid based on GA-PLS and SVMs, in Journal of Chemical Information and Computer Sciences, vol. 44, n. 1, 2004-01, pp. 161–167, DOI:10.1021/ci034173u. URL consultato il 22 aprile 2022.
- ^ Wolosker H, Dumin E, Balan L, Foltyn VN, D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration, in The FEBS Journal, vol. 275, n. 14, July 2008, pp. 3514–26, DOI:10.1111/j.1742-4658.2008.06515.x, PMID 18564180.
- ^ M. A. Rosanoff, On FIscher's Classification of Stereo-Isomers, in Journal of the American Chemical Society, vol. 29, n. 1, 1906, pp. 114-121, DOI:10.1021/ja01967a014, 100887371.
- ^ (EN) Thomas E Creighton, Proteins: structures and molecular properties, W.H. Freeman, 1993, ISBN 978-0-7167-2317-2, OCLC 25373213. URL consultato il 19 maggio 2022.
- ^ J. Kyte e R. F. Doolittle, A simple method for displaying the hydropathic character of a protein, in Journal of Molecular Biology, vol. 157, n. 1, 5 maggio 1982, pp. 105–132. URL consultato il 16 aprile 2018.
- ^ Lukasz P. Kozlowski, Proteome-pI: proteome isoelectric point database, in Nucleic Acids Research, vol. 45, D1, 4 gennaio 2017, pp. D1112–D1116, DOI:10.1093/nar/gkw978. URL consultato il 16 aprile 2018.
- ^ Chapter 1: Proteins are the Body's Worker Molecules - The Structures of Life - Science Education - National Institute of General Medical Sciences, su web.archive.org, 7 giugno 2014. URL consultato il 10 marzo 2022 (archiviato dall'url originale il 7 giugno 2014).
- ^ The First Sequence: Fred Sanger and Insulin, su academic.oup.com. URL consultato il 10 marzo 2022.
- ^ (EN) The Giant Protein Titin, su ahajournals.org.
- ^ Ognen A. C. Petroff, Book Review: GABA and Glutamate in the Human Brain, in The Neuroscientist, vol. 8, n. 6, 2002-12, pp. 562–573, DOI:10.1177/1073858402238515. URL consultato il 10 marzo 2022.
- ^ D. Schomburg e Gerhard Michal, Biochemical pathways : an atlas of biochemistry and molecular biology, 2nd ed, John Wiley & Sons, 2012, ISBN 978-0-470-14684-2, OCLC 758844712. URL consultato il 10 marzo 2022.
- ^ (EN) Giuseppe Genchi, An overview on d-amino acids, in Amino Acids, vol. 49, n. 9, 1º settembre 2017, pp. 1521–1533, DOI:10.1007/s00726-017-2459-5. URL consultato l'11 marzo 2022.
- ^ K.M. Coxon, E. Chakauya e H.H. Ottenhof, Pantothenate biosynthesis in higher plants, in Biochemical Society Transactions, vol. 33, n. 4, 1º agosto 2005, pp. 743–746, DOI:10.1042/BST0330743. URL consultato l'11 marzo 2022.
- ^ John W. Hylin, Toxic peptides and amino acids in foods and feeds, in Journal of Agricultural and Food Chemistry, vol. 17, n. 3, 1º maggio 1969, pp. 492–496, DOI:10.1021/jf60163a003. URL consultato l'11 marzo 2022.
- ^ (EN) B. L. Turner e J. B. Harborne, Distribution of canavanine in the plant kingdom, in Phytochemistry, vol. 6, n. 6, 1º gennaio 1967, pp. 863–866, DOI:10.1016/S0031-9422(00)86033-1. URL consultato l'11 marzo 2022.
- ^ (EN) Wolfgang Leuchtenberger, Klaus Huthmacher e Karlheinz Drauz, Biotechnological production of amino acids and derivatives: current status and prospects, in Applied Microbiology and Biotechnology, vol. 69, n. 1, 1º novembre 2005, pp. 1–8, DOI:10.1007/s00253-005-0155-y. URL consultato l'11 marzo 2022.
- ^ H. DeWayne Ashmead, Amino Acid Chelation in Human and Animal Nutrition, 10 febbraio 2012, DOI:10.1201/b11533. URL consultato l'11 marzo 2022.
- ^ (EN) S. Garattini, Glutamic Acid, Twenty Years Later, in The Journal of Nutrition, vol. 130, n. 4, 1º aprile 2000, pp. 901S–909S, DOI:10.1093/jn/130.4.901S. URL consultato l'11 marzo 2022.
- ^ (EN) L D Stegink, The aspartame story: a model for the clinical testing of a food additive, in The American Journal of Clinical Nutrition, vol. 46, n. 1, 1º luglio 1987, pp. 204–215, DOI:10.1093/ajcn/46.1.204. URL consultato l'11 marzo 2022.
- ^ (EN) Ferrochel®, su Human Nutrition & Health. URL consultato l'11 marzo 2022.
- ^ Ashmead, H. DeWayne., Foliar feeding of plants with amino acid chelates, Noyes Publications, 1986, ISBN 0-8155-1059-4, OCLC 12838275. URL consultato il 19 maggio 2022.
- ^ (EN) Erick H. Turner, Jennifer M. Loftis e Aaron D. Blackwell, Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan., in Pharmacology & therapeutics, vol. 109, n. 3, 1º marzo 2006, pp. 325–338, DOI:10.1016/j.pharmthera.2005.06.004. URL consultato il 19 maggio 2022.
- ^ (EN) R. M. Kostrzewa, P. Nowak e J. P. Kostrzewa, Peculiarities of L-DOPA treatment of Parkinson’s disease, in Amino Acids, vol. 28, n. 2, 1º marzo 2005, pp. 157–164, DOI:10.1007/s00726-005-0162-4. URL consultato il 19 maggio 2022.
- ^ (EN) O. Heby, L. Persson e M. Rentala, Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas’ disease, and leishmaniasis, in Amino Acids, vol. 33, n. 2, 1º agosto 2007, pp. 359–366, DOI:10.1007/s00726-007-0537-9. URL consultato il 19 maggio 2022.
- ^ Jianming Xie e Peter G Schultz, Adding amino acids to the genetic repertoire, in Current Opinion in Chemical Biology, vol. 9, n. 6, 2005-12, pp. 548–554, DOI:10.1016/j.cbpa.2005.10.011. URL consultato il 19 maggio 2022.
- ^ (EN) Qian Wang, Angela R. Parrish e Lei Wang, Expanding the Genetic Code for Biological Studies, in Chemistry & Biology, vol. 16, n. 3, 27 marzo 2009, pp. 323–336, DOI:10.1016/j.chembiol.2009.03.001. URL consultato il 19 maggio 2022.
- ^ Fumio Sanda e Takeshi Endo, <2651::aid-macp2651>3.0.co;2-p Syntheses and functions of polymers based on amino acids, in Macromolecular Chemistry and Physics, vol. 200, n. 12, 1º dicembre 1999, pp. 2651–2661, DOI:10.1002/(sici)1521-3935(19991201)200:12<2651::aid-macp2651>3.0.co;2-p. URL consultato il 19 maggio 2022.
- ^ (EN) Richard A. Gross e Bhanu Kalra, Biodegradable Polymers for the Environment, in Science, vol. 297, n. 5582, 2 agosto 2002, pp. 803–807, DOI:10.1126/science.297.5582.803. URL consultato il 19 maggio 2022.
- ^ Sunita M. Thombre e Bhimrao D. Sarwade, Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review, in Journal of Macromolecular Science, Part A, vol. 42, n. 9, 1º settembre 2005, pp. 1299–1315, DOI:10.1080/10601320500189604. URL consultato il 19 maggio 2022.
- ^ Sharon L. Bourke e Joachim Kohn, Polymers derived from the amino acid l-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol), in Advanced Drug Delivery Reviews, vol. 55, n. 4, 2003-04, pp. 447–466, DOI:10.1016/s0169-409x(03)00038-3. URL consultato il 19 maggio 2022.
- ^ Bob B. Internet Archive, Wilhelm Gruissem e Russell L. Jones, Biochemistry & molecular biology of plants, Rockville, Md. : American Society of Plant Physiologists, 2000, ISBN 978-0-943088-39-6. URL consultato il 19 maggio 2022.
- ^ (EN) Marsha A. Gaston, Liwen Zhang e Kari B. Green-Church, The complete biosynthesis of the genetically encoded amino acid pyrrolysine from lysine, in Nature, vol. 471, n. 7340, 2011-03, pp. 647–650, DOI:10.1038/nature09918. URL consultato il 19 maggio 2022.
- ^ John T. Brosnan e Margaret E. Brosnan, Glutathione and the Sulfur-Containing Amino Acids: An Overview, John Wiley & Sons, Inc., pp. 1–18. URL consultato il 19 maggio 2022.
- ^ Kari I. Kivirikko e Taina Pihlajaniemi, Collagen Hydroxylases and the Protein Disulfide Isomerase Subunit of Prolyl 4-Hydroxylases, John Wiley & Sons, Inc., 22 novembre 2006, pp. 325–398, DOI:10.1002/9780470123188.ch9, ISBN 978-0-470-12318-8. URL consultato il 19 maggio 2022.
- ^ (EN) L. Whitmore e B. A. Wallace, Analysis of peptaibol sequence composition: implications for in vivo synthesis and channel formation, in European Biophysics Journal, vol. 33, n. 3, 1º maggio 2004, pp. 233–237, DOI:10.1007/s00249-003-0348-1. URL consultato il 19 maggio 2022.
- ^ L. Alexander, Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening, in Journal of Experimental Botany, vol. 53, n. 377, 1º ottobre 2002, pp. 2039–2055, DOI:10.1093/jxb/erf072. URL consultato il 19 maggio 2022.
- ^ (EN) Karlheinz Drauz, Ian Grayson e Axel Kleemann, Amino Acids, Wiley-VCH Verlag GmbH & Co. KGaA, 15 aprile 2007, pp. a02_057.pub2, DOI:10.1002/14356007.a02_057.pub2, ISBN 978-3-527-30673-2. URL consultato il 19 maggio 2022.
- ^ (EN) J. Tze-Fei Wong, A Co-Evolution Theory of the Genetic Code, in Proceedings of the National Academy of Sciences, vol. 72, n. 5, 1975-05, pp. 1909–1912, DOI:10.1073/pnas.72.5.1909. URL consultato il 19 maggio 2022.
- ^ (EN) E. N Trifonov, Consensus temporal order of amino acids and evolution of the triplet code, in Gene, vol. 261, n. 1, 30 dicembre 2000, pp. 139–151, DOI:10.1016/S0378-1119(00)00476-5. URL consultato il 19 maggio 2022.
- ^ Paul G. Higgs e Ralph E. Pudritz, A Thermodynamic Basis for Prebiotic Amino Acid Synthesis and the Nature of the First Genetic Code, in Astrobiology, vol. 9, n. 5, 1º giugno 2009, pp. 483–490, DOI:10.1089/ast.2008.0280. URL consultato il 19 maggio 2022.
- ^ Anargyros Chaliotis, Panayotis Vlastaridis e Dimitris Mossialos, The complex evolutionary history of aminoacyl-tRNA synthetases, in Nucleic Acids Research, vol. 45, n. 3, 28 novembre 2016, pp. 1059–1068, DOI:10.1093/nar/gkw1182. URL consultato il 19 maggio 2022.
- ^ Berg, Jeremy M. (Jeremy Mark), 1958- e Stryer, Lubert., Biochemistry, 7th ed, W.H. Freeman, 2012, ISBN 978-1-4292-2936-4, OCLC 758952268.
- ^ Bill Bryson, Breve storia di (quasi) tutto, TEA, 2011, p. 321, ISBN 978-88-502-1549-2.
- ^ V. R. Young, Adult amino acid requirements: the case for a major revision in current recommendations, in The Journal of Nutrition, vol. 124, 8 Suppl, August 1994, pp. 1517S–1523S. URL consultato il 16 aprile 2018.
- ^ Fürst P, Stehle P, What are the essential elements needed for the determination of amino acid requirements in humans?, in The Journal of Nutrition, vol. 134, 6 Suppl, giugno 2004, pp. 1558S–1565S, PMID 15173430.
- ^ Reeds PJ, Dispensable and indispensable amino acids for humans, in The Journal of Nutrition, vol. 130, n. 7, luglio 2000, pp. 1835S–40S, PMID 10867060.
- ^ Driscoll DM, Copeland PR, Mechanism and regulation of selenoprotein synthesis, in Annual Review of Nutrition, vol. 23, n. 1, 2003, pp. 17–40, DOI:10.1146/annurev.nutr.23.011702.073318, PMID 12524431.
- ^ Krzycki JA, The direct genetic encoding of pyrrolysine, in Current Opinion in Microbiology, vol. 8, n. 6, dicembre 2005, pp. 706–12, DOI:10.1016/j.mib.2005.10.009, PMID 16256420.
- ^ D. R. Lide, Handbook of Chemistry and Physics, 72nd edition, Boca Raton, Florida, CRC press, 1991.
Voci correlate modifica
- Amminoacidi proteinogenici
- Amminoacidi non proteinogenici
- Amminoacidi essenziali
- Amminoacidi glucogenetici
- Amminoacidi chetogenici
- Amminoacidi insulinogenici
- Degradazione di Strecker
- Legame peptidico
- Peptidi
- Proteina
- Proteolisi
- Proteosintesi
- Racemizzazione degli amminoacidi
- Omochiralità
- Codice genetico
- Sequenza di DNA
- Esperimento di Miller-Urey
Altri progetti modifica
- Wikizionario contiene il lemma di dizionario «amminoacido»
- Wikimedia Commons contiene immagini o altri file sull'amminoacido
Collegamenti esterni modifica
- amminoacidi, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Michael K. Reddy, amino acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Amminoacido, su Open Library, Internet Archive.
| Controllo di autorità | Thesaurus BNCF 49 · LCCN (EN) sh85004486 · GND (DE) 4142205-3 · BNF (FR) cb11944322s (data) · J9U (EN, HE) 987007293901505171 · NDL (EN, JA) 00560236 |
|---|